Μία από τις πολλές φυσικοχημικές διεργασίες που έχουν ευρεία εφαρμογή, τόσο στη βιομηχανία όσο και στην καθημερινή ζωή, είναι η ηλεκτρόλυση - η επιλογή στις επιφάνειες των ηλεκτροδίων που συνδέονται με μια τρέχουσα πηγή τοποθετημένη σε ένα διάλυμα ή τήγμα, τα συστατικά τους (καθαρό μέταλλο - αλουμίνιο, χαλκός, αέριο, κ.λπ.). Η κύρια εγκατάσταση στην οποία πραγματοποιείται αυτή η διαδικασία είναι ένας ηλεκτρολύτης.

Ηλεκτρολύτης
Τι είναι ένας ηλεκτρολύτης
Ένας ηλεκτρολύτης είναι μια ειδική εγκατάσταση που χρησιμοποιείται για τον διαχωρισμό των συστατικών του από ένα διάλυμα ή τήγμα.
Τα κύρια χαρακτηριστικά του ηλεκτρολύτη είναι:
- Η τάση λειτουργίας για ένα ηλεκτρόδιο κυμαίνεται από 1,8 έως 2,0 V.
- Ισχύς ρεύματος - για την κανονική πορεία της διαδικασίας ηλεκτρόλυσης, παρέχεται ρεύμα στα ηλεκτρόδια με τιμή αυτού του χαρακτηριστικού από 5 έως 10 Α.
- Αριθμός ηλεκτροδίων - ο ελάχιστος αριθμός ηλεκτροδίων είναι 2, το μέγιστο περιορίζεται από το μέγεθος της ίδιας της εγκατάστασης και τον σκοπό της.
- Οι διαστάσεις των ηλεκτροδίων - όχι οι ράβδοι άνθρακα χρησιμοποιούνται ως ηλεκτρόδια, αλλά οι μεταλλικές πλάκες, το μέγεθος των οποίων καθορίζεται από τον σκοπό της εγκατάστασης, το χαρακτηριστικό ρεύματος-τάσης του ρεύματος που παρέχεται στις πλάκες.
- Απόσταση μεταξύ των αντίθετα φορτισμένων επιφανειών ηλεκτροδίων - η ελάχιστη απόσταση μεταξύ των πλακών ηλεκτροδίων πρέπει να είναι τουλάχιστον 1,5 mm.
- Υλικό ηλεκτροδίων - στους σύγχρονους ηλεκτρολύτες, φύλλο ανοξείδωτου με νικέλιο χρησιμοποιείται ως υλικό για την άνοδο και την κάθοδο.
Επίσης ένα άλλο σημαντικό χαρακτηριστικό μιας εγκατάστασης ηλεκτρόλυσης είναι η χρήση καταλυτών.
Τέτοιες εγκαταστάσεις χρησιμοποιούνται για τους ακόλουθους σκοπούς:
- Λήψη αερίου οξυϋδρογόνου, που αποτελείται από μείγμα υδρογόνου και οξυγόνου (αέριο Brown) ·
- Απομόνωση καθαρού αλουμινίου, μαγνησίου και ψευδαργύρου από τα αλάτι τους που λιώνουν.
- Καθαρισμός νερού από άλατα και ακαθαρσίες που διαλύονται σε αυτό.
- Εφαρμογή λεπτού στρώματος νικελίου, ψευδαργύρου που αποτρέπει τη διάβρωση στην επιφάνεια των μεταλλικών μερών
- Απολύμανση τροφίμων;
- Καθαρισμός λυμάτων από διαλυμένα άλατα βαρέων μετάλλων και άλλων επιβλαβών ουσιών.
Σπουδαίος! Το ηλεκτρόδιο λευκόχρυσου κατασκευασμένο από συνηθισμένο σίδηρο χρησιμοποιείται λιγότερο συχνά σε εγκαταστάσεις ηλεκτρόλυσης από ότι από ανοξείδωτο χάλυβα, καθώς οξειδώνεται ταχύτερα και καθίσταται άχρηστο.
Αυτο-κατασκευασμένος ηλεκτρολύτης
Ο καθένας μπορεί να φτιάξει έναν ηλεκτρολύτη με τα χέρια του. Για τη διαδικασία συναρμολόγησης του πιο κοινού σχεδιασμού, θα χρειαστούν τα ακόλουθα υλικά:
- φύλλο ανοξείδωτου (οι καλύτερες επιλογές είναι ξένα AISI 316L ή δικά μας 03X16H15M3).
- μπουλόνια М6х150;
- ροδέλες και παξιμάδια.
- διαφανής σωλήνας - μπορείτε να χρησιμοποιήσετε ένα αλφάδι, το οποίο χρησιμοποιείται για κατασκευαστικούς σκοπούς.
- διάφορα εξαρτήματα ψαροκόκαλου με εξωτερική διάμετρο 8 mm.
- πλαστικό δοχείο με όγκο 1,5 λίτρα.
- ένα μικρό φίλτρο νερού βρύσης, για παράδειγμα, ένα φίλτρο για πλυντήρια ρούχων.
- βαλβίδα νερού χωρίς επιστροφή.
Διαδικασία συναρμολόγησης
Συλλέξτε τον ηλεκτρολύτη με τα χέρια σας σύμφωνα με τις ακόλουθες οδηγίες:
- Πρώτα απ 'όλα, πρέπει να σημειώσετε και το επόμενο πριόνισμα του φύλλου από ανοξείδωτο χάλυβα σε ίδια τετράγωνα. Το πριόνι μπορεί να γίνει με γωνιακό μύλο (γωνιακό μύλο). Μία από τις γωνίες σε τέτοια τετράγωνα πρέπει να κοπεί υπό γωνία για τη σωστή στερέωση των πλακών.
- Στη συνέχεια, πρέπει να κάνετε μια τρύπα για το μπουλόνι στο πλάι της πλάκας απέναντι από τη γωνία κοπής.
- Η σύνδεση των πλακών πρέπει να γίνει με τη σειρά: μία πλάκα στο "+", η επόμενη στο "-" και ούτω καθεξής.
- Μεταξύ των διαφορετικών φορτισμένων πλακών πρέπει να υπάρχει ένας μονωτής, ο οποίος λειτουργεί ως σωλήνας από το αλφάδι.Θα πρέπει να κοπεί σε δακτυλίους, οι οποίοι πρέπει να κοπούν κατά μήκος για να ληφθούν λωρίδες πάχους 1 mm. Αυτή η απόσταση μεταξύ των πλακών είναι επαρκής για καλή εξέλιξη αερίου κατά την ηλεκτρόλυση.
- Οι πλάκες στερεώνονται μαζί χρησιμοποιώντας ροδέλες ως εξής: ένα πλυντήριο κάθεται στο μπουλόνι, στη συνέχεια μια πλάκα, στη συνέχεια τρία ροδέλες, μετά από μια πλάκα, και ούτω καθεξής. Οι πλάκες, με ευνοϊκή φόρτιση, τοποθετούνται σε καθρέφτη με αρνητικά φορτισμένα φύλλα. Αυτό καθιστά δυνατή την αποφυγή του πριονισμένου άκρου από το άγγιγμα των ηλεκτροδίων.


Πλάκες της εγκατάστασης ηλεκτρόλυσης συναρμολογούνται μαζί
- Κατά τη συναρμολόγηση των πλακών, πρέπει ταυτόχρονα να τα απομονώσετε και να σφίξετε τα παξιμάδια.
- Επίσης, κάθε πλάκα πρέπει να χτυπήσει για να βεβαιωθείτε ότι δεν υπάρχει βραχυκύκλωμα.
- Επιπλέον, ολόκληρο το συγκρότημα πρέπει να τοποθετηθεί σε πλαστικό κουτί.
- Μετά από αυτό, αξίζει να επισημάνετε τα μέρη όπου τα μπουλόνια αγγίζουν τα τοιχώματα του δοχείου, όπου ανοίγετε δύο οπές. Εάν τα μπουλόνια δεν χωράνε στο δοχείο, τότε πρέπει να κοπούν με πριόνι.
- Στη συνέχεια, τα μπουλόνια σφίγγονται με παξιμάδια και ροδέλες για τη στεγανότητα της κατασκευής.


Πλάκες τοποθετημένες σε πλαστικό δοχείο
- Μετά τα βήματα που ακολουθήσατε, θα χρειαστεί να κάνετε τρύπες στο καπάκι του δοχείου και να τοποθετήσετε τα εξαρτήματα σε αυτά. Η αδιαπερατότητα σε αυτήν την περίπτωση μπορεί να διασφαλιστεί σφραγίζοντας τις αρθρώσεις με στεγανωτικά με βάση σιλικόνη.
- Μια βαλβίδα ασφαλείας και ένα φίλτρο στη δομή βρίσκεται στην έξοδο του αερίου και χρησιμεύει ως μέσο ελέγχου της υπερβολικής συσσώρευσης αερίου, το οποίο μπορεί να οδηγήσει σε κακά αποτελέσματα
- Η μονάδα ηλεκτρόλυσης συναρμολογείται.
Το τελευταίο στάδιο είναι μια δοκιμή, η οποία εκτελείται με παρόμοιο τρόπο:
- γέμιση του δοχείου με νερό μέχρι το σημάδι των μπουλονιών για τους συνδετήρες.
- σύνδεση ισχύος με τη συσκευή.
- σύνδεση με την τοποθέτηση του σωλήνα, το αντίθετο άκρο του οποίου κατεβαίνει στο νερό.
Εάν εφαρμοστεί ασθενές ρεύμα στην εγκατάσταση, τότε η απελευθέρωση αερίου μέσω του σωλήνα θα είναι σχεδόν ανεπαίσθητη, αλλά θα είναι δυνατή η παρακολούθηση του από το εσωτερικό του ηλεκτρολύτη. Αυξάνοντας το εναλλασσόμενο ρεύμα, προσθέτοντας έναν αλκαλικό καταλύτη στο νερό, είναι δυνατόν να αυξηθεί σημαντικά η απόδοση της αέριας ουσίας.
Ο κατασκευασμένος ηλεκτρολύτης, κατά κανόνα, είναι ένα σημαντικό μέρος πολλών συσκευών, για παράδειγμα, ένας καυστήρας υδρογόνου.


η εμφάνιση ενός καυστήρα υδρογόνου, η βάση του οποίου θεωρείται ως αυτο-κατασκευασμένος ηλεκτρολύτης
Γνωρίζοντας τους τύπους, τα βασικά χαρακτηριστικά, τη συσκευή και την αρχή λειτουργίας των ιοντικών εγκαταστάσεων, μπορείτε να εκτελέσετε τη σωστή συναρμολόγηση μιας σπιτικής κατασκευής, η οποία είναι ένας εξαιρετικός βοηθός σε μια ποικιλία καθημερινών καταστάσεων: από τη συγκόλληση και την εξοικονόμηση κατανάλωσης καυσίμου οχημάτων με κινητήρα έως τη λειτουργία των συστημάτων θέρμανσης.
Συσκευή και αρχή λειτουργίας
Κάθοδος και άνοδος
Η απλούστερη μονάδα ηλεκτρόλυσης αποτελείται από πολλά "κύτταρα", καθένα από τα οποία περιλαμβάνει:
- 2 ηλεκτρόδια πλάκας - κάθοδος (αρνητική) και άνοδος (θετική).
- Ένα ελαστικό παρέμβυσμα γύρω από την περίμετρο δύο γειτονικών ανόμοιων ηλεκτροδίων.
Τα εξωτερικά κελιά είναι εξοπλισμένα με ειδικούς σωλήνες μέσω των οποίων εκλύονται τα εξελιγμένα αέρια.
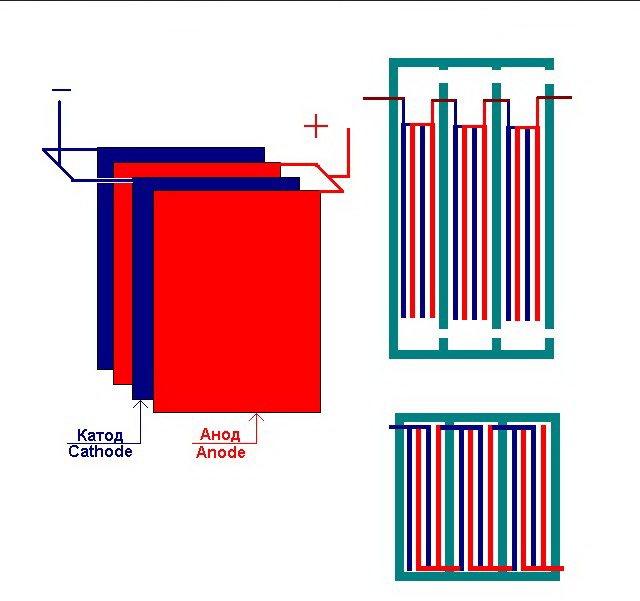

Αρκετά διασυνδεδεμένα "κύτταρα" της εγκατάστασης ηλεκτρόλυσης
Ο ηλεκτρολύτης μπορεί να περιέχει από 1 έως 30-40 ή περισσότερα τέτοια "κελιά", οι πλάκες με το ίδιο όνομα συνδέονται σε σειρά.
Σπουδαίος! Όταν χρησιμοποιείτε τροφοδοτικά με εναλλασσόμενο ρεύμα, χρησιμοποιούνται επίσης ανορθωτές, ο απλούστερος από τους οποίους είναι μια γέφυρα διόδων.
Μια τέτοια εγκατάσταση λειτουργεί ως εξής:
- Απεσταγμένο νερό με αλκάλι διαλυμένο σε αυτό ή συνηθισμένη μαγειρική σόδα χύνεται στο χώρο μεταξύ των ηλεκτροδίων.
- Παρέχεται τάση 1,8-2,0 V από την τροφοδοσία στα ηλεκτρόδια όλων των στοιχείων της εγκατάστασης.
- Ως αποτέλεσμα της διαδικασίας ηλεκτρόλυσης, ανιόντα (θετικά φορτισμένα ιόντα) μιας ουσίας διαλυμένης σε νερό προσελκύονται στην αρνητικά φορτισμένη κάθοδο, ως αποτέλεσμα της οποίας σχηματίζεται ένα λεπτό φιλμ νατρίου.
- Σε μια θετικά φορτισμένη άνοδο, συμβαίνει η καταστροφή των μορίων νερού, με το καθένα να σχηματίζεται 2 άτομα υδρογόνου και 1 άτομο οξυγόνου.
- Το απελευθερούμενο εκρηκτικό αέριο μέσω των σωλήνων διακλάδωσης εισέρχεται στο δοχείο που προορίζεται για αυτό.
Η ένταση της διαδικασίας ηλεκτρόλυσης εξαρτάται από την τάση και την ισχύ του ρεύματος - σε χαμηλές τιμές αυτών των χαρακτηριστικών, η διαδικασία δεν θα προχωρήσει. Εάν η πηγή τροφοδοσίας παρέχει ρεύμα με πολύ υψηλές τιμές του χαρακτηριστικού τάσης ρεύματος, το διάλυμα που χύνεται στον ηλεκτρολύτη θα είναι πολύ ζεστό και θα βράσει.
Εντοπισμός σφαλμάτων και έλεγχος της συσκευής
Στη συνέχεια, είναι απαραίτητο να προσδιορίσετε πού τα μπουλόνια αγγίζουν τα τοιχώματα του κιβωτίου και, σε αυτά τα μέρη, ανοίξτε δύο οπές. Εάν για μη προφανή λόγο αποδειχθεί ότι τα μπουλόνια δεν χωράνε στο δοχείο, τότε πρέπει κόψτε και σφίξτε για σφίξιμο με παξιμάδια... Τώρα πρέπει να ανοίξετε το κάλυμμα και να τοποθετήσετε τους σπειροειδείς συνδετήρες εκεί και από τις δύο πλευρές. Για να εξασφαλιστεί η στεγανότητα, ο σύνδεσμος πρέπει να σφραγίζεται με στεγανωτικό με βάση σιλικόνη.
Αφού συναρμολογήσετε τον δικό σας ηλεκτρολύτη με τα χέρια σας, θα πρέπει να το δοκιμάσετε. Για να το κάνετε αυτό, συνδέστε τη συσκευή σε μια πηγή τροφοδοσίας, γεμίστε το με νερό στα μπουλόνια, βάλτε το καπάκι συνδέοντας ένα σωλήνα στο εξάρτημα και κατεβάζοντας το αντίθετο άκρο του σωλήνα στο νερό. Εάν το ρεύμα είναι ασθενές, τότε το ρεύμα θα είναι ορατό από το εσωτερικό του ηλεκτρολύτη.
Αυξήστε σταδιακά το ρεύμα της σπιτικής σας συσκευής. Το απεσταγμένο νερό δεν μεταφέρει ηλεκτρισμό καλά επειδή δεν περιέχει άλατα ή ακαθαρσίες. Για την παρασκευή του ηλεκτρολύτη, είναι απαραίτητο να προσθέσετε αλκαλικά στο νερό. Για να το κάνετε αυτό, πρέπει να πάρετε υδροξείδιο του νατρίου (που περιέχεται σε μέσα καθαρισμού σωλήνων όπως το "Mole"). Απαιτείται βαλβίδα ασφαλείας για την αποφυγή συσσώρευσης αξιοπρεπούς ποσότητας αερίου.
- Είναι καλύτερο να χρησιμοποιείτε αποσταγμένο νερό και σόδα ως καταλύτη.
- Θα πρέπει να αναμίξετε λίγο από τη σόδα ψησίματος με σαράντα μέρη νερού. Οι τοίχοι στις πλευρές είναι καλύτερα κατασκευασμένοι από ακρυλικό γυαλί.
- Τα ηλεκτρόδια είναι καλύτερα κατασκευασμένα από ανοξείδωτο χάλυβα. Είναι λογικό να χρησιμοποιείτε χρυσό για πλάκες.
- Χρησιμοποιήστε διαφανές PVC για υποστήριξη. Μπορούν να έχουν μέγεθος 200 έως 160 χιλιοστά.
- Μπορείτε να χρησιμοποιήσετε τον δικό σας ηλεκτρολύτη, φτιαγμένος από εσάς, για να μαγειρέψετε φαγητό, για την πλήρη καύση βενζίνης σε αυτοκίνητα και στις περισσότερες περιπτώσεις.
Οι ξηροί ηλεκτρολύτες χρησιμοποιούνται κυρίως για μηχανήματα. Η γεννήτρια αυξάνει την ισχύ του κινητήρα καύσης. Το υδρογόνο αναφλέγεται πολύ γρηγορότερα από το υγρό καύσιμο, αυξάνοντας τη δύναμη του εμβόλου. Εκτός από το Mole, μπορείτε να πάρετε Mister Muscle, καυστική σόδα, μαγειρική σόδα.
Η γεννήτρια δεν λειτουργεί στο πόσιμο νερό. Είναι καλύτερο να συνδέσετε ηλεκτρική ενέργεια έτσι: την πρώτη και την τελευταία πλάκα - μείον και στην πλάκα στη μέση - συν. Όσο μεγαλύτερη είναι η περιοχή των πλακών και όσο ισχυρότερο είναι το ρεύμα, τόσο περισσότερο αέριο απελευθερώνεται.
Τύποι ηλεκτρολυτών
DIY spot συγκόλληση για μπαταρίες
Ανάλογα με το σχεδιασμό και την αρχή λειτουργίας, υπάρχουν 5 τύποι εγκαταστάσεων ηλεκτρόλυσης.
Ξηρός
Τέτοιοι ηλεκτρολύτες αποτελούνται από ηλεκτρόδια πλακών που διαχωρίζονται από σφραγισμένες φλάντζες από καουτσούκ. Συχνά, τα "κελιά" της εγκατάστασης τοποθετούνται επιπλέον σε ένα σφραγισμένο περίβλημα.
Το υδρογόνο και το οξυγόνο που παράγονται ως αποτέλεσμα της ηλεκτρόλυσης απομακρύνονται μέσω ειδικών σωλήνων διακλάδωσης που βρίσκονται στο τέλος του σώματος ή των ακραίων πλακών της εγκατάστασης.
Ρεύση
Οι εγκαταστάσεις ηλεκτρόλυσης αυτού του τύπου έχουν την ακόλουθη συσκευή:
- Ένα λουτρό ηλεκτρόλυσης (σώμα) με δύο ακροφύσια, μέσω του οποίου τροφοδοτείται ένας ηλεκτρολύτης, μέσω του δεύτερου εκκενώνεται το εκρηκτικό αέριο που σχηματίζεται ως αποτέλεσμα της ηλεκτρόλυσης.
- Ηλεκτρόδια πλάκας διαχωρισμένα με διαχωριστικά.
- Μια δεξαμενή με ηλεκτρολύτη που βρίσκεται πάνω από το περίβλημα με ηλεκτρόδια και συνδέεται με σωλήνες με τους σωλήνες διακλάδωσης του λουτρού ηλεκτρόλυσης της εγκατάστασης και έχει έναν σωλήνα διακλάδωσης με βαλβίδα αερίου στο πάνω μέρος.
Κατά τη λειτουργία μιας τέτοιας διάταξης, το εξελιγμένο αέριο μέσω του σωλήνα διακλάδωσης και του εύκαμπτου σωλήνα εισέρχεται στη δεξαμενή με τον ηλεκτρολύτη και, δημιουργώντας μια συγκεκριμένη πίεση σε αυτό, αφήνει την εγκατάσταση μέσω της βαλβίδας στον σωλήνα διακλάδωσης.
Μεμβράνη
Τα στοιχεία ηλεκτρόλυσης τέτοιων εγκαταστάσεων αποτελούνται από δύο ηλεκτρόδια που διαχωρίζονται από μια λεπτή μεμβράνη που επιτρέπει στα προϊόντα ηλεκτρόλυσης να περνούν και να διαχωρίζουν τα ηλεκτρόδια μεταξύ τους.
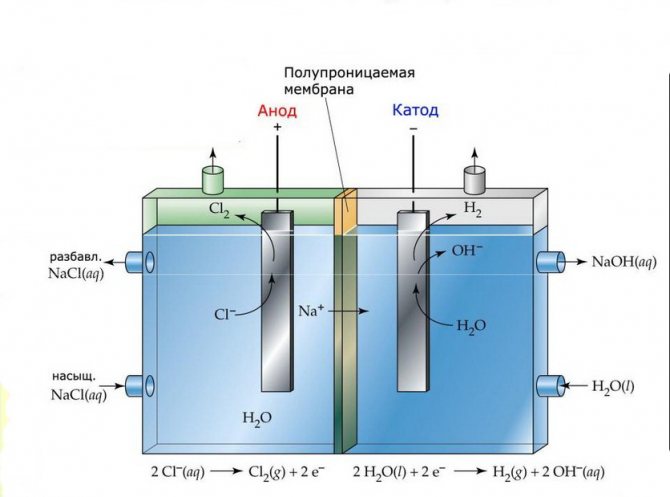

Μονάδα ηλεκτρολύσεως μεμβράνης
Διάφραγμα
Οι εγκαταστάσεις ηλεκτρόλυσης αυτού του τύπου αποτελούνται από μια φιάλη σχήματος "U" με δύο ηλεκτρόδια εισαγόμενα σε αυτήν και 2-3 αδιαπέραστα διαφράγματα. Παρόμοιοι ηλεκτρολύτες χρησιμοποιούνται για τη χωριστή παραγωγή καθαρού υδρογόνου και οξυγόνου.
Αλκαλική
Σε αντίθεση με άλλα μοντέλα ηλεκτρολυτών, σε αυτά, ένα διάλυμα αλκαλίου χρησιμοποιείται ως ηλεκτρολύτης - καυστική σόδα (υδροξείδιο του νατρίου), η οποία δεν είναι μόνο μια πρόσθετη πηγή υδρογόνου και οξυγόνου, αλλά και καταλύτης για την ηλεκτρόλυση.
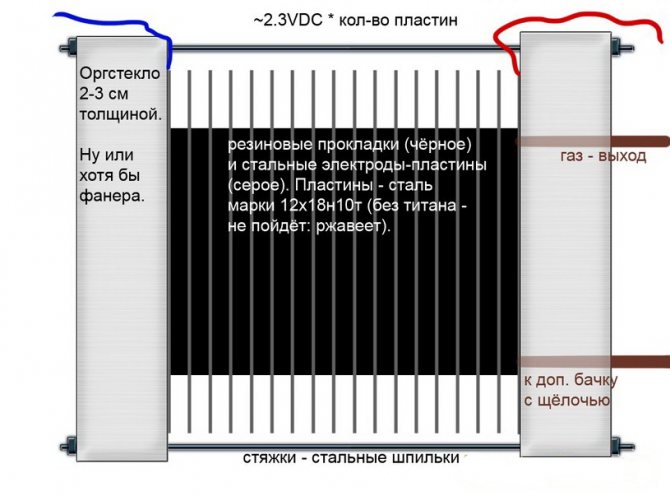

Κύκλωμα αλκαλικών ηλεκτρολυτών
Τέτοιες εγκαταστάσεις, σε αντίθεση με τα ανάλογα άλλων τύπων, επιτρέπουν τη χρήση φθηνότερων ηλεκτροδίων κατασκευασμένων από συνηθισμένο σίδερο.
Κάντε τον ηλεκτρολύτη με τα χέρια σας
Σίγουρα, είστε εξοικειωμένοι με τη διαδικασία ηλεκτρόλυσης από το πρόγραμμα σπουδών του δημοτικού σχολείου. Αυτό συμβαίνει όταν 2 πολικά ηλεκτρόδια τοποθετούνται σε νερό υπό ρεύμα προκειμένου να ληφθούν μέταλλα ή μη μέταλλα στην καθαρή τους μορφή. Απαιτείται ηλεκτρολύτης για την αποσύνθεση μορίων νερού σε οξυγόνο και υδρογόνο. Ο ηλεκτρολύτης, ως μέρος των επιστημονικών μηχανισμών, διαιρεί τα μόρια σε ιόντα.
Υπάρχουν δύο τύποι αυτής της συσκευής:
- Ξηρός ηλεκτρολύτης (αυτό είναι ένα εντελώς κλειστό κελί).
- Υγρός ηλεκτρολύτης (αυτές είναι δύο μεταλλικές πλάκες τοποθετημένες σε δοχείο νερού).
Αυτή η συσκευή είναι απλή από την άποψη της συσκευής, γεγονός που καθιστά δυνατή χρήση ακόμη και στο σπίτι... Οι ηλεκτρολύτες διαιρούν τα φορτία ηλεκτρόλυσης των ατόμων των μορίων σε φορτισμένα άτομα.
Στην περίπτωσή μας, διαιρεί το νερό σε θετικό υδρογόνο και αρνητικό οξυγόνο. Για να γίνει αυτό, απαιτείται μεγάλη ποσότητα ενέργειας και για να μειωθεί η απαιτούμενη ποσότητα ενέργειας, χρησιμοποιείται καταλύτης.
Ηλεκτρολύτης για παραγωγή υδρογόνου
Υπολογισμός γείωσης
Για να συναρμολογήσετε τον απλούστερο ηλεκτρολύτη με τα χέρια σας, μπορείτε να χρησιμοποιήσετε το σχέδιο που φαίνεται στην εικόνα.
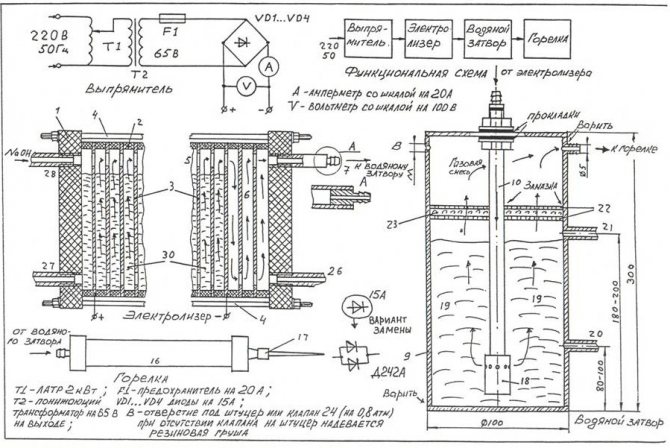

Σχέδιο του απλούστερου σπιτικού ηλεκτρολύτη
Σημείωση! Ένας ηλεκτρολύτης είναι μια μάλλον επικίνδυνη εγκατάσταση, η οποία, κατά τη λειτουργία, το αέριο οξυϋδρογόνο, που συσσωρεύεται σε μεγάλες ποσότητες, μπορεί να προκαλέσει σοβαρή έκρηξη. Η μονάδα δεν πρέπει να τοποθετείται κοντά σε πηγές ανοιχτής φωτιάς, συσκευές θέρμανσης.
Ηλεκτρολυτής DIY για αυτοκίνητο
Για να βελτιωθεί η καύση καυσίμου σε κινητήρα αυτοκινήτου, συναρμολογείται συχνά ένας ηλεκτρολύτης, που αποτελείται από ένα σώμα από μια παλιά μπαταρία με ανοξείδωτες πλάκες τοποθετημένες στο εσωτερικό, δύο ακροφύσια, ένα εκ των οποίων συνδέεται σε μια δεξαμενή γεμάτη με ηλεκτρολύτη, το δεύτερο είναι συνδεδεμένο με έναν εύκαμπτο σωλήνα παροχής αέρα στον κινητήρα (ακριβέστερα, με κυματοειδή από την εισαγωγή αέρα στο φίλτρο αέρα).
Ένας τέτοιος σπιτικός ηλεκτρολύτης που ρέει τροφοδοτείται από την μπαταρία του αυτοκινήτου χρησιμοποιώντας ένα ρελέ και μια ασφάλεια 10 Α.
Δημιουργούμε μια συσκευή με τα χέρια μας
Η συσκευή για αυτήν τη διαδικασία μπορεί να γίνει με το χέρι.
Για αυτό θα χρειαστείτε:
- Φύλλο ανοξείδωτου
- Μπουλόνια M6 x 150;
- Πλυντήρια;
- ΞΗΡΟΙ ΚΑΡΠΟΙ;
- Διαφανής σωλήνας;
- Σύνδεση στοιχείων με σπείρωμα και στις δύο πλευρές.
- Πλαστικό δοχείο ενάμισι λίτρου.
- Φίλτρο νερού;
- Ελέγξτε τη βαλβίδα για νερό.
Μια εξαιρετική επιλογή για ανοξείδωτο χάλυβα είναι το AISI 316L αλλοδαπού κατασκευαστή ή το 03X16H15M3 κατασκευαστή από τη χώρα μας. Δεν υπάρχει απολύτως καμία ανάγκη να αγοράσετε ανοξείδωτο χάλυβα, μπορείτε να πάρετε το παλιό. 50 έως 50 εκατοστά αρκούν για εσάς.
"Γιατί να πάρουμε το ίδιο το ανοξείδωτο χάλυβα;" - εσύ ρωτάς. Δεδομένου ότι το πιο κοινό μέταλλο θα διαβρωθεί. Το ανοξείδωτο χάλυβα ανέχεται καλύτερα τα αλκάλια. Πρέπει περιγράψτε το φύλλο με τέτοιο τρόπο ώστε να το διαιρέσετε σε 16 παρόμοια τετράγωνα... Μπορείτε να το κόψετε με γωνιακό μύλο. Σε κάθε τετράγωνο, κόψτε μία από τις γωνίες.
Στην άλλη πλευρά και στην απέναντι γωνία, από την πριονισμένη γωνία, ανοίξτε μια τρύπα για ένα μπουλόνι που θα σας βοηθήσει να συγκρατήσετε τις πλάκες μαζί. Ο ηλεκτρολύτης δεν σταματά να λειτουργεί έτσι:Το ρεύμα t πλάκας ρέει στην πλάκα - και το νερό αποσυντίθεται σε οξυγόνο και υδρογόνο. Χάρη σε αυτό, χρειαζόμαστε ένα καλό και αρνητικό πιάτο.
Οι πλάκες πρέπει να συνδέονται εναλλάξ: συν-πλην-συν-πλην, με παρόμοια μέθοδο, θα υπάρχει ισχυρό ρεύμα. Για να μονώσετε τις πλάκες μία προς μία, χρησιμοποιείται ένας σωλήνας. Ένα δαχτυλίδι κόβεται από το επίπεδο. Κόβοντας το, έχουμε πάχος χιλιοστόμετρου. Αυτή η απόσταση είναι πιο σωστή για την παραγωγή αερίου.
Οι πλάκες διασυνδέονται με ροδέλες: βάζουμε ένα πλυντήριο στο μπουλόνι, στη συνέχεια μια πλάκα και τρεις ροδέλες, στη συνέχεια μια πλάκα και ούτω καθεξής. Στο συν και πλην, πρέπει να φυτευτούν οκτώ πιάτα. Εάν όλα γίνουν σωστά, τότε τα τεμάχια των πλακών δεν θα αγγίξουν τα ηλεκτρόδια.
Τότε πρέπει να σφίξετε τα παξιμάδια και να απομονώσετε τις πλάκες. Στη συνέχεια τοποθετούμε τη δομή σε πλαστικό δοχείο.
Επισκόπηση κατασκευαστών ηλεκτρολυτών
Οι κύριοι παραγωγοί ηλεκτρολυτών είναι και οι δύο εγχώριες επιχειρήσεις (RUSAL, NPF RutTech, JSC Uralkhimmash), καθώς και οι ξένοι ανταγωνιστές τους - Teledyne Energy Systems, Inc (USA), Hydrogenics Corp. (Βέλγιο).
Έτσι, ο ηλεκτρολύτης είναι μια αρκετά απλή και πλούσια σε χαρακτηριστικά εγκατάσταση που χρησιμοποιείται για την παραγωγή αερίου οξυγόνου, το οποίο στο μέλλον προγραμματίζεται να χρησιμοποιηθεί ως καύσιμο για κινητήρες εσωτερικής καύσης και λέβητες θέρμανσης.
Κάνετε μόνοι σας ηλεκτρόλυση στο σπίτι
Όταν ήμουν μικρός, πάντα ήθελα να κάνω κάτι μόνοι μου, με τα χέρια μου. Αλλά οι γονείς (και άλλοι στενοί άνθρωποι) στις περισσότερες περιπτώσεις δεν το επέτρεπαν. Και δεν είδα τότε (και μέχρι τώρα δεν βλέπω) τίποτα κακό όταν τα μικρά παιδιά θέλουν να μάθουν;
Φυσικά, δεν έγραψα αυτό το άρθρο για να θυμηθώ τις εμπειρίες της παιδικής ηλικίας στην επιθυμία να ξεκινήσω την αυτο-εκπαίδευση. Τυχαία, όταν σερφάρισα στο Διαδίκτυο, συνάντησα μια τέτοια ερώτηση. Κάποιο μικρό βομβαρδιστικό αγόρι έκανε ερωτήσεις σχετικά με το πώς να κάνει ηλεκτρόλυση στο σπίτι. Είναι αλήθεια ότι δεν τον απάντησα, γιατί αυτό το αγόρι ήθελε να ηλεκτρολύσει το οδυνηρά ύποπτο μείγμα ;; Αποφάσισα ότι δεν θα έλεγα πιο μακριά από την αμαρτία, επιτρέψτε μου να κοιτάξω στα βιβλία μόνοι μου. Όμως πριν από λίγο καιρό, περιπλανώμενος ξανά στα φόρουμ, είδα μια παρόμοια ερώτηση από έναν δάσκαλο σε μια σχολή χημείας. Κρίνοντας από την περιγραφή, το σχολείο του είναι τόσο φτωχό που δεν μπορεί (δεν θέλει) να αγοράσει έναν ηλεκτρολύτη για 300 ρούβλια. Ο δάσκαλος (τι πρόβλημα!) Δεν μπόρεσε να βρει διέξοδο από την προκύπτουσα κατάσταση. Έτσι τον βοήθησα. Για όσους είναι περίεργοι για αυτό το είδος σπιτικών προϊόντων, δημοσιεύω αυτό το άρθρο στον ιστότοπο.
Στην πραγματικότητα, η διαδικασία παραγωγής και η χρήση της αυτο-παλέτας μας είναι πολύ πρωτόγονη. Αλλά θα σας πω πρώτα για την ασφάλεια και για την κατασκευή - στη δεύτερη. Και το θέμα είναι ότι μιλάμε για έναν ηλεκτρολύτη επίδειξης και όχι για μια βιομηχανική μονάδα. Χάρη σε αυτό, για λόγους ασφαλείας, θα ήταν καλό να το τροφοδοτήσετε όχι από το δίκτυο, αλλά από μπαταρίες AA ή από μπαταρία. Φυσικά, όσο υψηλότερη είναι η τάση, τόσο πιο γρήγορα θα προχωρήσει η διαδικασία της ηλεκτρόλυσης. Ωστόσο, για την οπτική παρατήρηση των φυσαλίδων αερίου, είναι αρκετά αρκετά 6 V, αλλά το 220 είναι ήδη υπερβολικό. με μια τέτοια τάση, το νερό, για παράδειγμα, θα βράσει το γρηγορότερο, και αυτό δεν είναι πολύ ασφαλές ... Λοιπόν, νομίζω ότι καταλάβατε την ένταση;
Τώρα ας μιλήσουμε για το πού και υπό ποιες συνθήκες θα πειραματιστούμε. Το πρώτο πράγμα, θα πρέπει να είναι είτε ελεύθερος χώρος είτε ένα καλά αεριζόμενο δωμάτιο. Αν και έκανα τα πάντα σε ένα διαμέρισμα με κλειστά παράθυρα και τίποτα παρόμοιο; Δεύτερον, το πείραμα γίνεται καλύτερα σε ένα καλό τραπέζι. Η λέξη "καλό" σημαίνει ότι το τραπέζι πρέπει να είναι σταθερό και καλύτερα βαρύ, άκαμπτο και προσαρτημένο στην επιφάνεια του δαπέδου. Σε αυτήν την περίπτωση, το κάλυμμα του τραπεζιού πρέπει να είναι ανθεκτικό σε επιθετικές ουσίες. Παρεμπιπτόντως, το πλακίδιο από ένα πλακάκι είναι ιδανικό για αυτό (αν και όχι όλα, δυστυχώς). Ένα τραπέζι σαν αυτό θα είναι χρήσιμο όχι μόνο για αυτήν την εμπειρία. Ωστόσο, έκανα τα πάντα σε ένα συνηθισμένο σκαμνί ;; Τρίτον, κατά τη διάρκεια του πειράματος, δεν χρειάζεται να μετακινήσετε την πηγή ισχύος (στην περίπτωσή μου, μπαταρίες). Λόγω αυτού, για λόγους αξιοπιστίας, είναι καλύτερο να τα τοποθετήσετε αμέσως στο τραπέζι και να τα διορθώσετε έτσι ώστε να μην κινούνται. Πιστέψτε με, αυτό είναι πιο βολικό από το να τα κρατάτε τακτικά με τα χέρια σας. Απλώς έδεσα τις μπαταρίες μου με ηλεκτρική ταινία στο πρώτο σκληρό αντικείμενο που είδα. Τέταρτον, τα πιάτα στα οποία θα πειραματιστούμε, αφήστε τα να είναι μικρά. Ένα απλό γυαλί ταιριάζει ή ένα γυάλινο τζάμι. Παρεμπιπτόντως, αυτός είναι ο βέλτιστος τρόπος χρήσης γυαλιών στο σπίτι, σε αντίθεση με την έκχυση αλκοόλ σε αυτά με περαιτέρω χρήση ...
Λοιπόν, τώρα ας στραφούμε ειδικά στη συσκευή. Παρέχεται στο σχήμα, αλλά προς το παρόν θα εξηγήσω εν συντομία τι και με τι.
Πρέπει να πάρουμε ένα απλό μολύβι και να αφαιρέσουμε το δέντρο από αυτό με ένα συνηθισμένο μαχαίρι και να βγάλουμε ολόκληρο το μολύβι από το μολύβι. Μπορείτε, ωστόσο, να προβάλετε ένα μηχανικό μολύβι. Υπάρχουν όμως δύο δυσκολίες ταυτόχρονα. Το πρώτο είναι το συνηθισμένο. Το μόλυβδο από ένα μηχανικό μολύβι είναι πολύ λεπτό, για εμάς αυτό απλά δεν είναι κατάλληλο για ένα οπτικό πείραμα. Η δεύτερη δυσκολία είναι κάποια ακατανόητη σύνθεση των τρεχόντων πλακών. Φαίνεται ότι δεν είναι κατασκευασμένα από γραφίτη, αλλά από κάτι άλλο. Σε γενικές γραμμές, η εμπειρία μου με ένα τέτοιο "μόλυβδο" δεν ήταν καθόλου επιτυχής, ακόμη και σε τάση 24 V. Χάρη σε αυτό, έπρεπε να διαλέξω ένα καλό ξυλώδες απλό μολύβι. Η προκύπτουσα ράβδος γραφίτη θα χρησιμεύσει ως ηλεκτρόδιο για εμάς. Όπως μπορείτε να φανταστείτε, χρειαζόμαστε δύο ηλεκτρόδια. Χάρη σε αυτό, πηγαίνουμε να διαλέξουμε το δεύτερο μολύβι ή απλά να σπάσουμε τα υπάρχοντα καλάμια στα δύο. Το έκανα πραγματικά.
Με οποιοδήποτε καλώδιο που έρχεται στο χέρι, τυλίγουμε το πρώτο ηλεκτρόδιο μολύβδου (με το ένα άκρο του καλωδίου) και συνδέουμε αυτό το καλώδιο στο μείον της πηγής ισχύος (με το άλλο άκρο). Στη συνέχεια παίρνουμε το δεύτερο προβάδισμα και κάνουμε το ίδιο με αυτό. Για αυτό, με βάση αυτό, χρειαζόμαστε ένα δεύτερο καλώδιο. Αλλά σε αυτήν την περίπτωση, συνδέουμε αυτό το καλώδιο με το πλεονέκτημα του τροφοδοτικού. Εάν αντιμετωπίζετε προβλήματα με την τοποθέτηση της εύθραυστης ράβδου γραφίτη στο καλώδιο, μπορείτε να χρησιμοποιήσετε τα εργαλεία που έχετε στο χέρι, όπως ταινία ή ταινία αγωγού. Εάν δεν λειτούργησε για να τυλίξει το άκρο του γραφίτη με το ίδιο το καλώδιο και η ταινία ή η μονωτική ταινία δεν παρείχε στενή επαφή, τότε προσπαθήστε να κολλήσετε το καλώδιο με αγώγιμη κόλλα. Εάν δεν έχετε αυτό, τουλάχιστον δέστε το καλώδιο στο καλώδιο με ένα νήμα. Δεν χρειάζεται να φοβάστε, το νήμα δεν θα καεί από τέτοια ένταση ;;
Για όσους δεν γνωρίζουν τίποτα για τις μπαταρίες και τους απλούς κανόνες για τη σύνδεσή τους, θα σας εξηγήσω λίγο. Η μπαταρία τύπου δακτύλου παράγει τάση 1,5 V. Στην εικόνα έχω δύο παρόμοιες μπαταρίες. Επιπλέον, συνδέονται σταδιακά - το ένα μετά το άλλο, όχι παράλληλα. Με μια παρόμοια (σειριακή) σύνδεση, η τελική τάση θα αθροιστεί από την τάση κάθε μπαταρίας, δηλαδή, για μένα είναι 1,5 + 1,5 = 3,0 V. Αυτό είναι μικρότερο από τα 6 volt που αναφέρθηκαν προηγουμένως. Αλλά ήμουν πολύ τεμπέλης για να αγοράσω μερικές ακόμη μπαταρίες. Αρχή εσείς και έτσι πρέπει να είστε ξεκάθαροι;
Ας ξεκινήσουμε το πείραμα. Για παράδειγμα, ας περιοριστούμε στην ηλεκτρόλυση του νερού.Πρώτον, είναι πολύ προσιτό (ελπίζω ότι ο αναγνώστης αυτού του άρθρου δεν ζει στη Σαχάρα) και δεύτερον, είναι ακίνδυνο. Επιπλέον, θα δείξω πώς να κάνω δύο διάφορος εμπειρία. Νομίζω ότι έχετε αρκετή φαντασία για να βρείτε πολλά παρόμοια πειράματα με άλλες ουσίες; Γενικά, το νερό της βρύσης είναι κατάλληλο για εμάς. Προτείνω όμως να προσθέσετε λίγο περισσότερο και αλάτι. Λίγο - αυτό σημαίνει μια μικρή πρέζα, όχι ένα ολόκληρο κουτάλι επιδόρπιο. Αυτό είναι σημαντικό! Ανακατέψτε καλά το αλάτι για να διαλυθεί. Έτσι, το νερό, που είναι διηλεκτρικό σε καθαρή κατάσταση, θα μεταφέρει τέλεια ηλεκτρική ενέργεια. στην αρχή του πειράματος, σκουπίστε το τραπέζι από πιθανή υγρασία και, στη συνέχεια, τοποθετήστε την πηγή ισχύος και ένα ποτήρι νερό.
Κατεβάζουμε και τα δύο ηλεκτρόδια, που βρίσκονται υπό τάση, στο νερό. Ταυτόχρονα, βεβαιωθείτε ότι μόνο ο γραφίτης βυθίζεται στο νερό και ότι το ίδιο το καλώδιο δεν πρέπει να αγγίζει το νερό. Η έναρξη του πειράματος μπορεί να καθυστερήσει. Ο χρόνος εξαρτάται από πολλούς δείκτες: τη σύνθεση του νερού, την ποιότητα των καλωδίων, την ποιότητα του γραφίτη και, φυσικά, την τάση της πηγής ισχύος. Η έναρξη της αντίδρασης μου καθυστέρησε για μερικά δευτερόλεπτα. Το οξυγόνο αρχίζει να εξελίσσεται στο ηλεκτρόδιο που ήταν συνδεδεμένο με το συν των μπαταριών. Το υδρογόνο θα απελευθερωθεί στο ηλεκτρόδιο που είναι συνδεδεμένο στο μείον. Πρέπει να σημειωθεί ότι υπάρχουν περισσότερες φυσαλίδες υδρογόνου. Πολύ μικρές φυσαλίδες κολλάνε γύρω από το τμήμα του γραφίτη που βυθίζεται στο νερό. Στη συνέχεια, μερικές από τις φυσαλίδες αρχίζουν να επιπλέουν.
Ηλεκτρόδιο στην αρχή του πειράματος. Δεν υπάρχουν ακόμη φυσαλίδες αερίου. Φυσαλίδες υδρογόνου που σχηματίζονται στο ηλεκτρόδιο συνδέονται με τον αρνητικό πόλο των μπαταριών
Ποια άλλα πειράματα μπορούν να υπάρξουν; Εάν έχετε ήδη παίξει αρκετά με υδρογόνο και οξυγόνο, προχωράμε σε ένα άλλο πείραμα. Είναι πιο ενδιαφέρον, ειδικά για οικιακούς ερευνητές. Είναι ενδιαφέρον το ότι είναι δυνατόν όχι μόνο να το δούμε, αλλά και να το μυρίσουμε. Στην προηγούμενη εμπειρία, λάβαμε οξυγόνο και υδρογόνο, τα οποία, κατά τη γνώμη μου, δεν είναι πολύ θεαματικά. Και σε ένα άλλο πείραμα, έχουμε δύο ουσίες (παρεμπιπτόντως χρήσιμες στην καθημερινή ζωή). στην αρχή του πειράματος, σταματήστε το προηγούμενο πείραμα και στεγνώστε τα ηλεκτρόδια. Τώρα πάρτε επιτραπέζιο αλάτι (το οποίο συνήθως χρησιμοποιείτε στην κουζίνα) και διαλύστε το στη μάζα του νερού. Σε αυτήν την περίπτωση, όχι ένα μικρό ποσό. Στην πραγματικότητα, μια αξιοπρεπής ποσότητα αλατιού είναι το μόνο πράγμα που κάνει τη δεύτερη εμπειρία διαφορετική από την πρώτη. Αφού διαλύσετε το αλάτι, μπορείτε να επαναλάβετε αμέσως το πείραμα. Τώρα λαμβάνει χώρα μια διαφορετική αντίδραση. Σε ένα καλό ηλεκτρόδιο, δεν απελευθερώνεται τώρα οξυγόνο, αλλά χλώριο. Και αρνητικά, απελευθερώνεται επίσης υδρογόνο. Όσον αφορά το γυαλί στο οποίο βρίσκεται το διάλυμα άλατος, το υδροξείδιο του νατρίου παραμένει σε αυτό μετά από παρατεταμένη ηλεκτρόλυση. Αυτή είναι η γνωστή καυστική σόδα, αλκάλια.
Χλώριο, θα μπορείτε να το μυρίσετε. Αλλά για το καλύτερο αποτέλεσμα, προτείνω να πάρετε τάση τουλάχιστον 12 V. Διαφορετικά, μπορεί να μην αισθανθείτε το άρωμα. Η παρουσία αλκαλίων (μετά από πολύ μεγάλη ηλεκτρόλυση) στο γυαλί μπορεί να ελεγχθεί με διάφορους τρόπους. Το πιο απλό και πιο βίαιο είναι να βάζετε το χέρι σας στο ποτήρι. Ένας εθνοτικός οιωνός λέει ότι εάν ξεκινήσει μια αίσθηση καψίματος, υπάρχει αλκαλικό στο ποτήρι. Ένας εξυπνότερος και πιο διακριτός τρόπος είναι η δοκιμή litmus. Εάν το σχολείο σας είναι τόσο φτωχό που δεν μπορεί καν να αποκτήσει ένα litmus, θα σας βοηθήσουν οι εύχρηστοι δείκτες. Ένα από αυτά, όπως λένε, μπορεί να χρησιμεύσει ως σταγόνα χυμού τεύτλων ;; Αλλά είναι πολύ πιθανό να ρίξετε λίγο λίπος στο διάλυμα. Από όσο γνωρίζω, πρέπει να πραγματοποιηθεί σαπωνοποίηση.
Για τους πολύ περίεργους, θα περιγράψω τι πραγματικά συνέβη κατά τη διάρκεια των πειραμάτων. Στο πρώτο πείραμα, υπό την επίδραση ενός ηλεκτρικού ρεύματος, πραγματοποιήθηκε μια παρόμοια αντίδραση: 2 H2O >>> 2 H2 + O2 Και τα δύο αέρια επιπλέουν φυσικά από το νερό στην επιφάνεια. Παρεμπιπτόντως, τα αιωρούμενα αέρια μπορούν να παγιδευτούν. Μπορείτε να το κάνετε μόνοι σας;
Σε ένα άλλο πείραμα, η αντίδραση ήταν εντελώς διαφορετική.Ξεκίνησε επίσης με ηλεκτρικό ρεύμα, αλλά τώρα όχι μόνο νερό, αλλά και αλάτι ενεργούσε ως αντιδραστήρια: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Λάβετε υπόψη ότι η αντίδραση πρέπει να λάβει χώρα σε περίσσεια νερού. Για να μάθετε ποια ποσότητα αλατιού θεωρείται η μεγαλύτερη, μπορείτε να την μετρήσετε από την παραπάνω αντίδραση. Μπορείτε επίσης να σκεφτείτε πώς να βελτιώσετε τη συσκευή ή ποια άλλα πειράματα μπορούν να γίνουν. Πράγματι, είναι πιθανό να ληφθεί υποχλωριώδες νάτριο με ηλεκτρόλυση. Στις εργαστηριακές συνθήκες, στις περισσότερες περιπτώσεις, λαμβάνεται με διοχέτευση αερίου χλωρίου μέσω διαλύματος υδροξειδίου του νατρίου.