Uno de los muchos procesos fisicoquímicos que han encontrado una amplia aplicación, tanto en la industria como en la vida cotidiana, es la electrólisis: la selección en las superficies de electrodos conectados a una fuente de corriente, colocados en una solución o fundidos, sus componentes (metal puro - aluminio , cobre, gas, etc.). La instalación principal en cuyo interior se desarrolla este proceso es un electrolizador.

Electrolizador
Que es un electrolizador
Un electrolizador es una instalación especial que se utiliza para separar sus componentes de una solución o fusión.
Las principales características del electrolizador son:
- El voltaje de operación para un electrodo varía de 1.8 a 2.0 V;
- Intensidad de la corriente: para el curso normal del proceso de electrólisis, se suministra una corriente a los electrodos con un valor de esta característica de 5 a 10 A;
- Número de electrodos: el número mínimo de electrodos es 2, el máximo está limitado por el tamaño de la instalación en sí y su propósito;
- Dimensiones de los electrodos: no se utilizan varillas de carbono como electrodos, sino placas de metal, cuyo tamaño está determinado por el propósito de la instalación, la característica de corriente-voltaje de la corriente suministrada a las placas;
- Distancia entre superficies de electrodos con carga opuesta: la distancia mínima entre las placas de electrodos debe ser de al menos 1,5 mm;
- Material del electrodo: en los electrolizadores modernos, se utiliza una lámina de acero inoxidable con níquel como material para el ánodo y el cátodo.
También otra característica importante de una planta de electrólisis es el uso de catalizadores.
Estas instalaciones se utilizan para los siguientes fines:
- Obtención de un gas oxihidrógeno, constituido por una mezcla de hidrógeno y oxígeno (gas de Brown);
- Aislamiento de aluminio puro, magnesio, zinc de sus sales fundidas;
- Purificación de agua de sales e impurezas disueltas en ella;
- Aplicación de una fina capa de níquel, zinc que evita la corrosión en la superficie de las piezas metálicas;
- Desinfección de productos alimenticios;
- Purificación de aguas residuales a partir de sales disueltas de metales pesados y otras sustancias nocivas.
¡Importante! El electrodo de platino hecho de hierro ordinario se usa con menos frecuencia en instalaciones de electrólisis que el de acero inoxidable, ya que se oxida más rápido y se vuelve inutilizable.
Electrolizador de fabricación propia
Cualquiera puede hacer un electrolizador con sus propias manos. Para el proceso de ensamblaje del diseño más común, se necesitarán los siguientes materiales:
- chapa de acero inoxidable (las mejores opciones son extranjeras AISI 316L o las nuestras 03X16H15M3);
- tornillos М6х150;
- arandelas y nueces;
- tubo transparente: puede usar un nivel de burbuja, que se usa para fines de construcción;
- varios herrajes en espiga con un diámetro exterior de 8 mm;
- un recipiente de plástico con un volumen de 1,5 litros;
- un pequeño filtro que filtra el agua del grifo, por ejemplo, un filtro para lavadoras;
- válvula de retención de agua.
proceso de ensamblaje
Recoja el electrolizador con sus propias manos de acuerdo con las siguientes instrucciones:
- En primer lugar, debe marcar y el posterior aserrado de la hoja de acero inoxidable en cuadrados idénticos. El aserrado se puede hacer con una amoladora angular (amoladora angular). Una de las esquinas de dichos cuadrados debe cortarse en ángulo para la correcta fijación de las placas;
- A continuación, debe hacer un agujero para el perno en el lado de la placa opuesto al corte de sierra de esquina;
- La conexión de las placas debe realizarse a su vez: una placa en "+", la siguiente en "-" y así sucesivamente;
- Entre las placas con carga diferente debería haber un aislante, que actúa como un tubo desde el nivel de burbuja.Se debe cortar en anillos, que se deben cortar a lo largo para obtener tiras de 1 mm de espesor. Esta distancia entre las placas es suficiente para un buen desprendimiento de gas durante la electrólisis;
- Las placas se sujetan entre sí con arandelas de la siguiente manera: una arandela se coloca en el perno, luego una placa, luego tres arandelas, después de una placa, y así sucesivamente. Las placas, cargadas favorablemente, se colocan en una imagen especular de hojas cargadas negativamente. Esto permite evitar que los bordes aserrados toquen los electrodos;


Placas de la planta de electrólisis ensambladas
- Al ensamblar las placas, debe aislarlas y apretar las tuercas simultáneamente;
- Además, cada placa debe anillarse para asegurarse de que no haya cortocircuito;
- Además, todo el conjunto debe colocarse en una caja de plástico;
- Después de eso, vale la pena resaltar los lugares donde los pernos tocan las paredes del contenedor, donde perfora dos agujeros. Si los pernos no encajan en el contenedor, entonces deben cortarse con una sierra para metales;
- Luego se aprietan los pernos con tuercas y arandelas para la estanqueidad de la estructura;


Platos colocados en un recipiente de plástico.
- Después de seguir los pasos, deberá hacer agujeros en la tapa del recipiente e insertar los accesorios en ellos. La impermeabilidad en este caso se puede asegurar sellando las juntas con selladores a base de silicona;
- Una válvula de seguridad y un filtro en la estructura están ubicados en la salida del gas y sirven como un medio para controlar la acumulación excesiva de gas, lo que puede conducir a malos resultados;
- La unidad de electrólisis está montada.
La última etapa es una prueba, que se realiza de manera similar:
- llenar el recipiente con agua hasta la marca de los pernos para sujetadores;
- conectar la energía al dispositivo;
- conexión al racor del tubo, cuyo extremo opuesto se baja al agua.
Si se aplica una corriente débil a la instalación, entonces la liberación de gas a través del tubo será casi imperceptible, pero será posible observarlo desde el interior del electrolizador. Aumentando la corriente alterna, agregando un catalizador alcalino al agua, el rendimiento de gas se puede incrementar significativamente.
El electrolizador fabricado suele ser una parte importante de muchos dispositivos, por ejemplo, un quemador de hidrógeno.


la aparición de un quemador de hidrógeno, cuya base se considera un electrolizador de fabricación propia
Al conocer los tipos, las características clave, el dispositivo y el principio de funcionamiento de las instalaciones iónicas, puede realizar el montaje correcto de una estructura casera, que es un excelente asistente en una variedad de situaciones cotidianas: desde la soldadura y el ahorro de consumo de combustible de los vehículos de motor hasta el funcionamiento de los sistemas de calefacción.
Dispositivo y principio de funcionamiento.
Cátodo y ánodo
La planta de electrólisis más simple consta de varias "celdas", cada una de las cuales incluye:
- 2 electrodos de placa: cátodo (negativo) y ánodo (positivo);
- Una junta de goma alrededor del perímetro de dos electrodos diferentes adyacentes.
Las celdas externas están equipadas con tuberías especiales a través de las cuales se descargan los gases desprendidos.
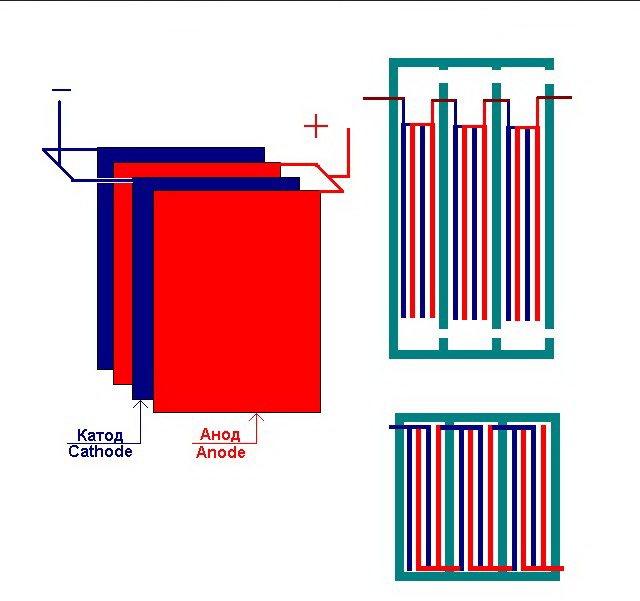

Varias "celdas" interconectadas de la planta de electrólisis
El electrolizador puede contener de 1 a 30-40 o más de tales "celdas", las placas del mismo nombre están conectadas en serie.
¡Importante! Cuando se utilizan fuentes de alimentación con corriente alterna, también se utilizan rectificadores, el más simple de los cuales es un puente de diodos.
Tal instalación funciona de la siguiente manera:
- Se vierte agua destilada con álcali disuelto o bicarbonato de sodio ordinario en el espacio entre los electrodos;
- Se suministra un voltaje de 1.8-2.0 V desde la fuente de alimentación a los electrodos de todas las celdas de la instalación;
- Como resultado del proceso de electrólisis, los aniones (iones cargados positivamente) de una sustancia disuelta en agua son atraídos hacia el cátodo cargado negativamente, como resultado de lo cual se forma una película delgada de sodio sobre él;
- En un ánodo cargado positivamente, se produce la destrucción de las moléculas de agua, mientras que de cada uno se forman 2 átomos de hidrógeno y 1 átomo de oxígeno;
- El gas detonante liberado a través de los ramales ingresa al recipiente destinado a él.
La intensidad del proceso de electrólisis depende del voltaje y la intensidad de la corriente; a valores bajos de estas características, el proceso no continuará. Si la fuente de alimentación suministra una corriente con valores demasiado altos de la característica corriente-voltaje, la solución vertida en el electrolizador estará muy caliente y se evaporará.
Depuración y prueba del dispositivo.
Luego es necesario determinar dónde los pernos tocan las paredes de la caja y, en esos lugares, perforar dos agujeros. Si sin razón aparente resulta que los pernos no encajan en el contenedor, entonces deben cortar y apretar para apretar con tuercas... Ahora debe perforar la cubierta e insertar los conectores roscados allí desde ambos lados. Para asegurar la impermeabilidad, la junta debe sellarse con un sellador a base de silicona.
Después de ensamblar su propio electrolizador con sus propias manos, debe probarlo. Para hacer esto, conecte el dispositivo a una fuente de alimentación, llénelo de agua hasta los tornillos, coloque la tapa conectando un tubo al accesorio y bajando el extremo opuesto del tubo al agua. Si la corriente es débil, entonces la corriente será visible desde el interior del electrolizador.
Aumenta la potencia de tu electrodoméstico casero paso a paso. El agua destilada no conduce bien la electricidad, ya que no contiene sales e impurezas. Para preparar el electrolito, es necesario agregar álcali al agua. Para hacer esto, debe tomar hidróxido de sodio (contenido en medios para limpiar tuberías como "Mole"). Se necesita una válvula de seguridad para evitar que se acumule una cantidad decente de gas.
- Es mejor usar agua destilada y soda como catalizador.
- Debe mezclar un poco de bicarbonato de sodio con cuarenta partes de agua. Las paredes de los lados están mejor hechas de vidrio acrílico.
- Lo mejor es que los electrodos estén hechos de acero inoxidable. Tiene sentido usar oro para las planchas.
- Utilice PVC translúcido como respaldo. Pueden tener un tamaño de 200 por 160 milímetros.
- Puede utilizar su propio electrolizador, fabricado por usted mismo, para cocinar alimentos, para la combustión completa de gasolina en automóviles y en la mayoría de los casos.
Los electrolizadores secos se utilizan principalmente para máquinas. El generador aumenta la potencia del motor de combustión. El hidrógeno se enciende mucho más rápido que el combustible líquido, aumentando la fuerza del pistón. Además de Mole, puede tomar Mister Muscle, soda cáustica, bicarbonato de sodio.
El generador no funciona con agua potable. Es mejor conectar la electricidad de esta manera: la primera y la última placa, menos, y en la placa en el medio, más. Cuanto mayor sea el área de las placas y más fuerte sea la corriente, más gas se libera.
Tipos de electrolizadores
Soldadura por puntos de bricolaje para baterías
Según el diseño y el principio de funcionamiento, existen 5 tipos de plantas de electrólisis.
Seco
Dichos electrolizadores consisten en electrodos en forma de placa separados por juntas de goma selladas. A menudo, las "celdas" de la instalación se colocan adicionalmente en un recinto sellado.
El hidrógeno y el oxígeno generados como resultado de la electrólisis se eliminan a través de ramales especiales ubicados en el extremo del cuerpo o en las placas extremas de la instalación.
Fluido
Las instalaciones de electrólisis de este tipo cuentan con el siguiente dispositivo:
- Un baño de electrólisis (cuerpo) con dos boquillas, a través de una de las cuales se alimenta el electrolito, a través de la segunda se descarga el gas detonante formado como resultado de la electrólisis;
- Electrodos de placa separados por espaciadores;
- Un tanque con electrolito ubicado encima de la carcasa con electrodos y conectado por mangueras a los ramales del baño de electrólisis de la instalación y que tiene un ramal con válvula de gas en la parte superior.
Durante el funcionamiento de dicho dispositivo, el gas desprendido a través de la tubería de derivación y la manguera ingresa al tanque con el electrolito y, creando una cierta presión en él, sale de la instalación a través de la válvula en la tubería de derivación.
Membrana
Las celdas de electrólisis de tales instalaciones constan de dos electrodos separados por una fina membrana que permite el paso de los productos de electrólisis y separa los electrodos entre sí.
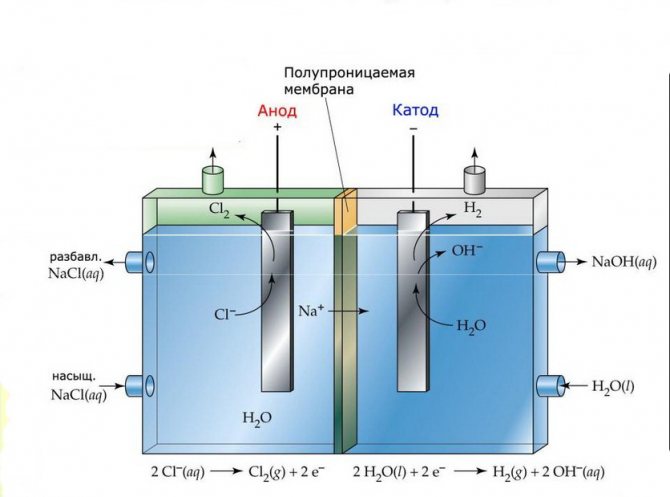

Planta de electrólisis de membranas
Diafragma
Las instalaciones de electrólisis de este tipo consisten en un matraz en forma de "U" con dos electrodos insertados y 2-3 diafragmas impermeables. Se utilizan electrolizadores similares para la producción separada de hidrógeno y oxígeno puros.
Alcalino
A diferencia de otros modelos de electrolizadores, en estos, se usa una solución alcalina como electrolito: sosa cáustica (hidróxido de sodio), que no solo es una fuente adicional de hidrógeno y oxígeno, sino también un catalizador para la electrólisis.
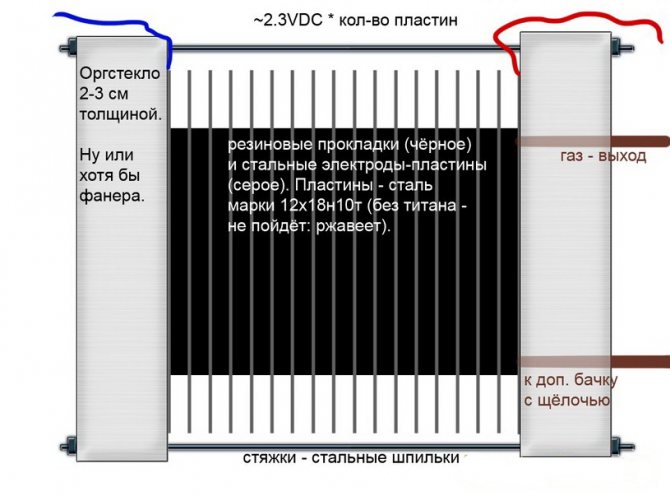

Circuito de electrolizador alcalino
Tales instalaciones, a diferencia de los análogos de otros tipos, permiten el uso de electrodos más baratos hechos de hierro ordinario.
Haz el electrolizador con tus propias manos.
Seguramente, está familiarizado con el proceso de electrólisis del plan de estudios de la escuela primaria. Esto es cuando se colocan 2 electrodos polares en el agua bajo corriente para obtener metales o no metales en su forma pura. Se necesita un electrolizador para descomponer las moléculas de agua en oxígeno e hidrógeno. El electrolizador, como parte de los mecanismos científicos, divide las moléculas en iones.
Hay dos tipos de este dispositivo:
- Electrolizador seco (esta es una celda completamente cerrada);
- Electrolizador húmedo (son dos placas de metal colocadas en un recipiente con agua).
Este dispositivo es simple en términos de dispositivo, lo que permite usar incluso en casa... Los electrolizadores dividen las cargas de electrólisis de los átomos de moléculas en átomos cargados.
En nuestro caso, divide el agua en hidrógeno positivo y oxígeno negativo. Para hacer esto se requiere una gran cantidad de energía, y para hacer menos de la cantidad requerida de energía, se usa un catalizador.
Electrolizador para producción de hidrógeno
Cálculo de puesta a tierra
Para ensamblar el electrolizador más simple con sus propias manos, puede usar el dibujo que se muestra en la figura.
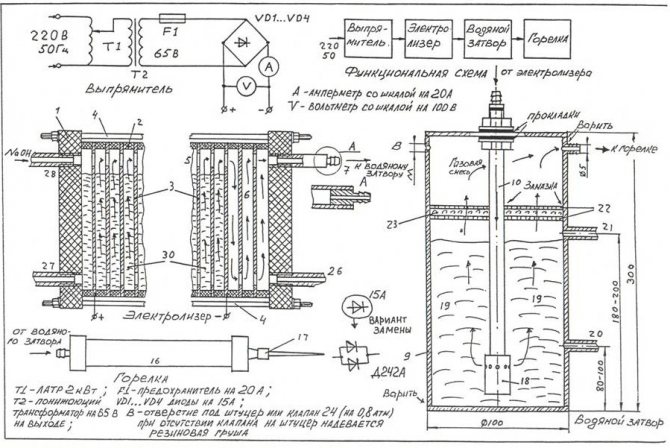

Dibujo del electrolizador casero más simple.
¡Nota! Un electrolizador es una instalación bastante peligrosa que, durante el funcionamiento, el gas oxihidrógeno, acumulado en grandes cantidades, puede provocar una explosión grave. La unidad no debe colocarse cerca de fuentes de fuego abierto, dispositivos de calefacción.
Electrolizador de bricolaje para un coche
Para mejorar la combustión del combustible en el motor de un automóvil, a menudo se ensambla un electrolizador, que consiste en un cuerpo de una batería vieja con placas de acero inoxidable colocadas en su interior, dos boquillas, una de las cuales está conectada a un tanque lleno de electrolito, la segunda es conectado a una manguera de suministro de aire al motor (más precisamente, con un corrugado de la entrada de aire al filtro de aire).
Un electrolizador de flujo casero de este tipo se alimenta con la batería del automóvil mediante un relé y un fusible de 10 A.
Creamos un dispositivo con nuestras propias manos.
El dispositivo para este proceso se puede hacer a mano.
Para esto necesitarás:
- Hoja de acero inoxidable;
- Pernos M6 x 150;
- Arandelas;
- Nueces;
- Tubo transparente;
- Elementos de conexión con hilo en ambos lados;
- Envase de plástico de un litro y medio;
- Filtro de agua;
- Compruebe si hay agua en la válvula.
Una excelente opción para acero inoxidable es AISI 316L de un fabricante extranjero o 03X16H15M3 de un fabricante de nuestro país. No hay absolutamente ninguna necesidad de comprar acero inoxidable, puede llevarse el antiguo. De 50 a 50 centímetros es suficiente para ti.
"¿Por qué tomar el acero inoxidable en sí?" - usted pregunta. Dado que el metal más común se corroe. El acero inoxidable tolera mejor los álcalis. Deberían delinear la hoja de tal manera que se divida en 16 cuadrados similares... Puedes cortarlo con una amoladora angular. En cada cuadrado, corte una de las esquinas.
En el otro lado y en la esquina opuesta, desde la esquina recortada, taladre un agujero para un perno que ayudará a mantener las placas juntas. El electrolizador no deja de funcionar así:t placa de electricidad fluye a la placa - y el agua se descompone en oxígeno e hidrógeno. Gracias a esto, necesitamos una placa buena y negativa.
Las placas deben conectarse alternativamente: más-menos-más-menos, con un método similar, habrá una fuerte corriente. Para aislar las placas una de una, se utiliza un tubo. Se corta un anillo del nivel. Al cortarlo obtenemos una tira de un milímetro de grosor. Esta distancia es más correcta para producir gas.
Las placas están interconectadas con arandelas: colocamos una arandela en el perno, luego una placa y tres arandelas, luego una placa nuevamente, y así sucesivamente. En el más y el menos, se deben plantar ocho platos. Si todo se hace correctamente, los cortes de las placas no tocarán los electrodos.
Entonces necesitas apretar las tuercas y aislar las placas. Luego colocamos la estructura en un recipiente de plástico.
Descripción general de los fabricantes de celdas electrolíticas
Los principales productores de electrolizadores son tanto empresas nacionales (RUSAL, NPF RutTech, JSC Uralkhimmash) como sus competidores extranjeros: Teledyne Energy Systems, Inc (EE. UU.), Hydrogenics Corp. (Bélgica).
Por lo tanto, el electrolizador es una instalación bastante simple y rica en funciones que se utiliza para producir gas oxhídrico, que en el futuro está previsto que se utilice como combustible para motores de combustión interna y calderas de calefacción.
Electrólisis casera de bricolaje
Cuando era pequeño, siempre quise hacer algo yo mismo, con mis propias manos. Pero los padres (y otras personas cercanas) en la mayoría de los casos no lo permitieron. ¿Y yo no veía entonces (y hasta ahora no veo) nada malo cuando los niños pequeños quieren aprender?
Por supuesto, no escribí este artículo para recordar experiencias de la infancia en el deseo de comenzar la autoeducación. Por casualidad, mientras navegaba por Internet, me encontré con una pregunta de este tipo. Un pequeño bombardero hizo preguntas sobre cómo hacer la electrólisis en casa. Es cierto, no le respondí, porque este chico quería electrolizar la mezcla dolorosamente sospechosa ??? Decidí que no diría más lejos del pecado, déjame buscar en los libros yo mismo. Pero no hace mucho, volviendo a deambular por los foros, vi una pregunta similar de un profesor de una escuela de química. A juzgar por la descripción, su escuela es tan pobre que no puede (no quiere) comprar un electrolizador por 300 rublos El maestro (¡qué problema!) No pudo encontrar una salida a la situación resultante. Entonces lo ayudé. Para aquellos que sienten curiosidad por este tipo de productos caseros, publico este artículo en el sitio.
En realidad, el proceso de producción y el uso de nuestro martillo automático es muy primitivo. Pero les contaré sobre la seguridad en primer lugar y sobre la fabricación, ya en el segundo. Y es que estamos hablando de un electrolizador demostrativo, y no de una instalación industrial. Gracias a esto, por seguridad, será bueno alimentarlo no desde la red, sino de pilas AA o de una batería. Naturalmente, cuanto mayor sea el voltaje, más rápido será el proceso de electrólisis. Sin embargo, para la observación visual de burbujas de gas, es bastante suficiente 6 V, pero 220 ya es excesivo. con tal voltaje, el agua, por ejemplo, hervirá más rápido que cualquier otra cosa, pero esto no es muy seguro ... Bueno, creo que lo has descubierto con la tensión.
Ahora hablemos de dónde y bajo qué condiciones experimentaremos. Lo primero, debe ser un espacio libre o una habitación bien ventilada. Aunque hice todo en un piso con las ventanas cerradas y nada parecido? En segundo lugar, es mejor hacer el experimento en una buena mesa. La palabra "buena" significa que la mesa debe ser estable y mejor pesada, rígida y sujeta a la superficie del piso. En este caso, el revestimiento de la mesa debe ser resistente a sustancias agresivas. Por cierto, un mosaico de un mosaico es perfecto para esto (aunque no todos, desafortunadamente). Una mesa como esta será útil no solo para esta experiencia. Sin embargo, ¿hice todo en un taburete ordinario? En tercer lugar, durante el experimento, no es necesario mover la fuente de alimentación (en mi caso, las baterías). Gracias a esto, para mayor confiabilidad, es mejor colocarlos inmediatamente sobre la mesa y arreglarlos para que no se muevan. Créame, esto es más conveniente que sostenerlos regularmente con las manos. Simplemente até mis propias baterías con cinta aislante al primer objeto duro que encontré. En cuarto lugar, los platos en los que comenzaremos a experimentar, que sean pequeños. Cabe un vaso simple o un vaso de chupito. Por cierto, esta es la forma más óptima de usar vasos en casa, en lugar de verter alcohol en ellos con el uso posterior ...
Bueno, ahora vayamos específicamente al dispositivo. Se proporciona en la figura, pero por ahora explicaré brevemente qué y qué.
Necesitamos tomar un lápiz simple y quitarle el árbol con un cuchillo común y sacar una mina entera del lápiz. Sin embargo, puede tomar la iniciativa de un portaminas. Pero hay dos dificultades a la vez. El primero es el habitual. La mina de un portaminas es demasiado fina, para nosotros simplemente no es adecuada para un experimento visual. La segunda dificultad es una composición incomprensible de las pizarras actuales. Parece que no están hechos de grafito, sino de otra cosa. En general, mi experiencia con tal "mina" no tuvo éxito en absoluto, incluso a un voltaje de 24 V. Gracias a esto, tuve que elegir un buen lápiz simple amaderado. La varilla de grafito resultante nos servirá de electrodo. Como puede imaginar, necesitamos dos electrodos. Gracias a esto, vamos a coger el segundo lápiz, o simplemente partimos la varilla existente en dos. De hecho hice esto.
Con cualquier cable que tengamos a mano, envolvemos el primer electrodo conductor (con un extremo del cable), y conectamos este cable al menos de la fuente de alimentación (con el otro extremo). Luego tomamos la segunda ventaja y hacemos lo mismo con ella. Para esto, en base a esto, necesitamos un segundo cable. Pero en este caso, conectamos este cable al positivo de la fuente de alimentación. Si tiene problemas para sujetar la frágil varilla de grafito al cable, puede usar las herramientas a mano, como cinta adhesiva o cinta adhesiva. Si no funcionó para envolver la punta del grafito con el cable en sí, y la cinta o la cinta aislante no proporcionaron un contacto firme, intente pegar el cable con pegamento conductor. Si no tiene esto, al menos ate el cable al cable con un hilo. No hay necesidad de tener miedo, ¿el hilo no se quemará con tal voltaje?
Para aquellos que no saben nada de baterías y reglas simples para su conexión, les explicaré un poco. La batería de tipo dedo emite un voltaje de 1,5 V. En la imagen tengo dos baterías similares. Además, están conectados gradualmente - uno tras otro, no en paralelo. Con dicha conexión (en serie), el voltaje final se sumará a partir del voltaje de cada batería, es decir, para mí es 1.5 + 1.5 = 3.0 V. Esto es menos que los 6 voltios declarados anteriormente. Pero era demasiado vago para comprar algunas baterías más. Principio tu y asi debes ser claro ??
Empecemos el experimento. Por ejemplo, limitémonos a la electrólisis del agua.Primero, es muy accesible (espero que el lector de este artículo no viva en el Sahara), y segundo, es inofensivo. Además, mostraré cómo con el mismo dispositivo (electrolizador) con la misma sustancia (agua) para realizar dos varios experiencia. Creo que tienes suficiente imaginación para hacer un montón de experimentos similares con otras sustancias. En general, el agua del grifo es adecuada para nosotros. Pero te recomiendo que le agregues un poco más y le pongas sal. Un poco - esto significa una pizca pequeña, no una cuchara de postre entera. ¡Esto es importante! Revuelva bien la sal para que se disuelva. Entonces, el agua, al ser un dieléctrico en estado puro, conducirá perfectamente la electricidad. al comienzo del experimento, limpie la mesa de la humedad potencial y luego coloque la fuente de energía y un vaso de agua sobre ella.
Bajamos ambos electrodos, presentes bajo voltaje, al agua. Al mismo tiempo, asegúrese de que solo el grafito esté sumergido en el agua y que el cable no toque el agua. El comienzo del experimento puede retrasarse. El tiempo depende de muchos indicadores: de la composición del agua, la calidad de los cables, la calidad del grafito y, por supuesto, el voltaje de la fuente de alimentación. El comienzo de mi reacción se retrasó un par de segundos. El oxígeno comienza a desprenderse del electrodo que estaba conectado al plus de las baterías. Se liberará hidrógeno en el electrodo conectado al menos. Cabe señalar que hay más burbujas de hidrógeno. Se pegan burbujas muy pequeñas alrededor de la parte del grafito que está sumergida en el agua. Luego, algunas de las burbujas comienzan a flotar.
Electrodo al inicio del experimento. Todavía no hay burbujas de gas. Se formaron burbujas de hidrógeno en el electrodo conectado al polo negativo de las baterías.
¿Qué otros experimentos puede haber? Si ya ha jugado lo suficiente con hidrógeno y oxígeno, procedemos a otro experimento. Es más interesante, especialmente para los investigadores domésticos. Es interesante porque es posible no solo verlo, sino también olerlo. En la experiencia pasada recibimos oxígeno e hidrógeno que, en mi opinión, no son muy espectaculares. Y en otro experimento, obtenemos dos sustancias (útiles en la vida cotidiana, por cierto). al comienzo del experimento, detenga el experimento anterior y seque los electrodos. Ahora tome sal de mesa (que usa en la mayoría de los casos en la cocina) y disuélvala en la masa de agua. En este caso, no una pequeña cantidad. En realidad, una cantidad decente de sal es lo único que hace que la segunda experiencia sea diferente de la primera. Después de disolver la sal, puede repetir el experimento inmediatamente. Ahora se está produciendo una reacción diferente. En un buen electrodo, no es oxígeno lo que se libera ahora, sino cloro. Y en el negativo, también se libera hidrógeno. En cuanto al vidrio en el que se encuentra la solución salina, el hidróxido de sodio permanece en él después de una electrólisis prolongada. Esta es la conocida sosa cáustica, álcali.
Cloro, podrás olerlo. Pero para obtener el mejor efecto, recomiendo tomar un voltaje de al menos 12 V. De lo contrario, es posible que no sienta el aroma. La presencia de álcali (después de una electrólisis muy prolongada) en el vidrio se puede comprobar de varias formas. La más sencilla y violenta es meter la mano en el vaso. Un presagio étnico dice que si comienza una sensación de ardor, hay álcali en el vaso. La forma más inteligente y distinta es la prueba de fuego. Si su escuela es tan pobre que ni siquiera es capaz de adquirir un tornasol, los indicadores útiles le ayudarán. Uno de estos, como dicen, ¿puede servir como una gota de jugo de remolacha? Pero es muy posible echar un poco de grasa en la solución. Hasta donde yo sé, debería producirse la saponificación.
Para los más curiosos, describiré lo que realmente sucedió durante los experimentos. En el primer experimento, bajo la influencia de una corriente eléctrica, tuvo lugar una reacción similar: 2 H2O >>> 2 H2 + O2 Ambos gases flotan naturalmente desde el agua hacia la superficie. Por cierto, los gases flotantes pueden quedar atrapados. ¿Puedes hacerlo por ti mismo?
En otro experimento, la reacción fue completamente diferente.También se inició con una corriente eléctrica, pero ahora no solo el agua, sino también la sal actuaron como reactivos: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Tenga en cuenta que la reacción debe tener lugar en un exceso de agua. Para saber qué cantidad de sal se considera la mayor, puede contarla a partir de la reacción anterior. También puede pensar en cómo mejorar el dispositivo o qué otros experimentos se pueden hacer. De hecho, es posible que se pueda obtener hipoclorito de sodio por electrólisis. En condiciones de laboratorio, en la mayoría de los casos, se obtiene pasando cloro gaseoso a través de una solución de hidróxido de sodio.