L'un des nombreux processus physico-chimiques qui ont trouvé une large application, à la fois dans l'industrie et dans la vie quotidienne, est l'électrolyse - la sélection sur les surfaces d'électrodes connectées à une source de courant placée dans une solution ou fondre, leurs composants (métal pur - aluminium, cuivre, gaz, etc.). L'installation principale à l'intérieur de laquelle se déroule ce processus est un électrolyseur.

Électrolyseur
Qu'est-ce qu'un électrolyseur
Un électrolyseur est une installation spéciale utilisée pour séparer ses constituants d'une solution ou d'une fusion.
Les principales caractéristiques de l'électrolyseur sont:
- La tension de fonctionnement pour une électrode varie de 1,8 à 2,0 V;
- Intensité du courant - pour le déroulement normal du processus d'électrolyse, un courant est fourni aux électrodes avec une valeur de cette caractéristique de 5 à 10 A;
- Nombre d'électrodes - le nombre minimum d'électrodes est de 2, le maximum est limité par la taille de l'installation elle-même et son objectif;
- Dimensions des électrodes - pas des tiges de carbone sont utilisées comme électrodes, mais des plaques métalliques dont la taille est déterminée par le but de l'installation, la caractéristique courant-tension du courant fourni aux plaques;
- Distance entre les surfaces d'électrode de charge opposée - la distance minimale entre les plaques d'électrode doit être d'au moins 1,5 mm;
- Matériau d'électrode - dans les électrolyseurs modernes, une feuille d'acier inoxydable avec du nickel est utilisée comme matériau pour l'anode et la cathode.
Une autre caractéristique importante d'une installation d'électrolyse est l'utilisation de catalyseurs.
Ces installations sont utilisées aux fins suivantes:
- Obtention d'un gaz oxyhydrogène, constitué d'un mélange d'hydrogène et d'oxygène (gaz de Brown);
- Isolement de l'aluminium pur, du magnésium et du zinc de leurs sels fondus;
- Purification de l'eau des sels et des impuretés dissous dans celle-ci;
- Application d'une fine couche de nickel, zinc qui empêche la corrosion à la surface des pièces métalliques;
- Désinfection des produits alimentaires;
- Purification des eaux usées à partir de sels dissous de métaux lourds et d'autres substances nocives.
Important! L'électrode de platine en fer ordinaire est moins souvent utilisée dans les installations d'électrolyse qu'en acier inoxydable, car elle s'oxyde plus rapidement et devient inutilisable.
Electrolyseur fait maison
N'importe qui peut fabriquer un électrolyseur de ses propres mains. Pour le processus d'assemblage de la conception la plus courante, les matériaux suivants seront nécessaires:
- tôle d'acier inoxydable (les meilleures options sont AISI 316L étranger ou le nôtre 03X16H15M3);
- boulons М6х150;
- rondelles et écrous;
- tube transparent - vous pouvez utiliser un niveau à bulle, qui est utilisé à des fins de construction;
- plusieurs raccords à chevrons d'un diamètre extérieur de 8 mm;
- récipient en plastique d'un volume de 1,5 litre;
- un petit filtre filtrant l'eau du robinet, par exemple un filtre pour lave-linge;
- clapet anti-retour d'eau.
processus d'assemblage
Récupérez l'électrolyseur de vos propres mains en suivant les instructions suivantes:
- Tout d'abord, vous devez marquer et scier ensuite la tôle d'acier inoxydable en carrés identiques. Le sciage peut être fait avec une meuleuse d'angle (meuleuse d'angle). L'un des coins de ces carrés doit être coupé à un angle pour fixer correctement les plaques;
- Ensuite, vous devez faire un trou pour le boulon sur le côté de la plaque opposé à la coupe de la scie d'angle;
- La connexion des plaques doit se faire tour à tour: une plaque sur "+", la suivante sur "-" et ainsi de suite;
- Entre les plaques chargées différemment, il devrait y avoir un isolant, qui agit comme un tube à partir du niveau à bulle.Il doit être coupé en anneaux, qui doivent être coupés dans le sens de la longueur pour obtenir des bandes de 1 mm d'épaisseur. Cette distance entre les plaques est suffisante pour un bon dégagement de gaz lors de l'électrolyse;
- Les plaques sont fixées ensemble à l'aide de rondelles comme suit: une rondelle repose sur le boulon, puis une plaque, puis trois rondelles, après une plaque, et ainsi de suite. Les plaques, chargées favorablement, sont placées dans une image miroir de feuilles chargées négativement. Cela permet d'éviter que les bords sciés ne touchent les électrodes;


Plaques de l'installation d'électrolyse assemblées
- Lors de l'assemblage des plaques, vous devez simultanément les isoler et serrer les écrous;
- De plus, chaque plaque doit être annelée afin d'être sûr qu'il n'y a pas de court-circuit;
- De plus, l'ensemble complet doit être placé dans une boîte en plastique;
- Après cela, il convient de mettre en évidence les endroits où les boulons touchent les parois du conteneur, où vous percez deux trous. Si les boulons ne rentrent pas dans le conteneur, ils doivent être coupés avec une scie à métaux;
- Ensuite, les boulons sont serrés avec des écrous et des rondelles pour l'étanchéité de la structure;


Plaques placées dans un récipient en plastique
- Après les étapes suivies, vous devrez percer des trous dans le couvercle du conteneur et y insérer les raccords. L'imperméabilité dans ce cas peut être assurée en scellant les joints avec des mastics à base de silicone;
- Une soupape de sécurité et un filtre dans la structure sont situés à la sortie du gaz et servent de moyen de contrôle de l'accumulation excessive de gaz, ce qui peut conduire à de mauvais résultats;
- L'unité d'électrolyse est assemblée.
La dernière étape est un test, qui est effectué de la même manière:
- remplir le récipient avec de l'eau jusqu'à la marque des boulons pour les attaches;
- connecter l'alimentation à l'appareil;
- raccordement au raccord du tube dont l'extrémité opposée est descendue dans l'eau.
Si un faible courant est fourni à l'installation, alors le dégagement de gaz à travers le tube sera presque imperceptible, mais il sera possible de le surveiller de l'intérieur de l'électrolyseur. En augmentant le courant alternatif, en ajoutant un catalyseur alcalin à l'eau, le rendement en gaz peut être considérablement augmenté.
L'électrolyseur fabriqué, en règle générale, est une partie importante de nombreux appareils, par exemple un brûleur à hydrogène.


l'apparence d'un brûleur à hydrogène, dont la base est considérée comme un électrolyseur fabriqué soi-même
Connaissant les types, les caractéristiques clés, le dispositif et le principe de fonctionnement des installations ioniques, vous pouvez effectuer l'assemblage correct d'une structure faite maison, qui est un excellent assistant dans une variété de situations quotidiennes: du soudage et des économies de consommation de carburant des véhicules à moteur à le fonctionnement des systèmes de chauffage.
Appareil et principe de fonctionnement
Cathode et anode
L'installation d'électrolyse la plus simple se compose de plusieurs "cellules", dont chacune comprend:
- 2 électrodes à plaques - cathode (négative) et anode (positive);
- Un joint en caoutchouc autour du périmètre de deux électrodes différentes adjacentes.
Les cellules extérieures sont équipées de tuyaux spéciaux à travers lesquels les gaz dégagés sont évacués.
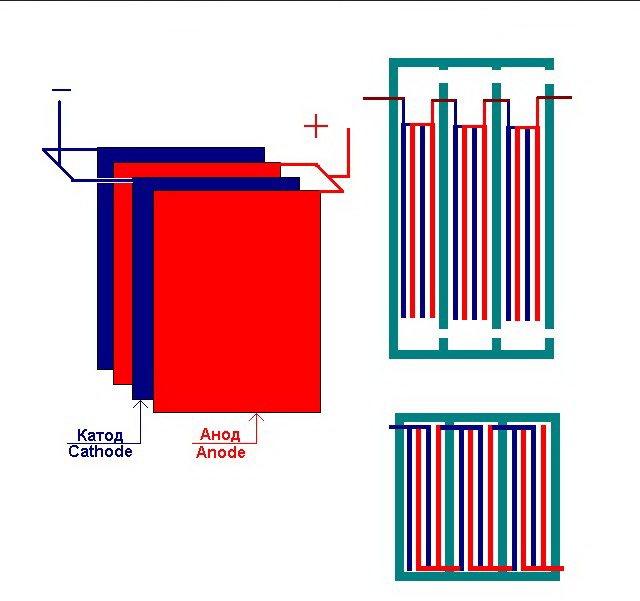

Plusieurs "cellules" interconnectées de l'usine d'électrolyse
L'électrolyseur peut contenir de 1 à 30-40 ou plus de telles "cellules", les plaques du même nom sont connectées en série.
Important! Lors de l'utilisation d'alimentations à courant alternatif, des redresseurs sont également utilisés, dont le plus simple est un pont de diodes.
Une telle installation fonctionne comme suit:
- De l'eau distillée contenant un alcali dissous ou du bicarbonate de soude ordinaire est versée dans l'espace entre les électrodes;
- Une tension de 1,8-2,0 V est fournie par l'alimentation aux électrodes de toutes les cellules de l'installation;
- À la suite du processus d'électrolyse, les anions (ions chargés positivement) d'une substance dissoute dans l'eau sont attirés vers la cathode chargée négativement, ce qui entraîne la formation d'un mince film de sodium dessus;
- Sur une anode chargée positivement, la destruction des molécules d'eau se produit, avec chacune formé 2 atomes d'hydrogène et 1 atome d'oxygène;
- Le gaz détonant libéré par les tuyaux de dérivation pénètre dans le récipient qui lui est destiné.
L'intensité du processus d'électrolyse dépend de la tension et de la force du courant - à de faibles valeurs de ces caractéristiques, le processus ne se poursuivra pas. Si la source d'alimentation fournit un courant avec des valeurs trop élevées de la caractéristique courant-tension, la solution versée dans l'électrolyseur sera très chaude et bouillira.
Débogage et test de l'appareil
Ensuite, il est nécessaire de déterminer où les boulons touchent les parois de la boîte et, à ces endroits, percer deux trous. Si, sans raison apparente, il s'avère que les boulons ne rentrent pas dans le conteneur, ils doivent couper et serrer pour l'étanchéité avec des écrous... Vous devez maintenant percer le couvercle et y insérer les connecteurs filetés des deux côtés. Pour assurer l'imperméabilité, le joint doit être scellé avec un mastic à base de silicone.
Après avoir assemblé votre propre électrolyseur de vos propres mains, vous devez le tester. Pour ce faire, connectez l'appareil à une source d'alimentation, remplissez-le d'eau jusqu'aux boulons, mettez le couvercle en connectant un tube au raccord et en abaissant l'extrémité opposée du tube dans l'eau. Si le courant est faible, le courant sera visible de l'intérieur de l'électrolyseur.
Augmentez progressivement le courant de votre appareil maison. L'eau distillée ne conduit pas bien l'électricité car elle ne contient ni sels ni impuretés. Pour préparer l'électrolyte, il est nécessaire d'ajouter un alcali à l'eau. Pour ce faire, vous devez prendre de l'hydroxyde de sodium (contenu dans des moyens de nettoyage des tuyaux tels que "Mole"). Une soupape de sécurité est nécessaire pour empêcher une quantité décente de gaz de s'accumuler.
- Il est préférable d'utiliser de l'eau distillée et de la soude comme catalyseur.
- Vous devez mélanger une partie du bicarbonate de soude avec quarante parties d'eau. Les murs sur les côtés sont mieux en verre acrylique.
- Les électrodes sont de préférence en acier inoxydable. Il est logique d'utiliser de l'or pour les assiettes.
- Utilisez du PVC translucide pour le support. Ils peuvent avoir une taille de 200 par 160 millimètres.
- Vous pouvez utiliser votre propre électrolyseur, fabriqué par vous-même, pour cuire les aliments, pour la combustion complète de l'essence dans les voitures et dans la plupart des cas.
Les électrolyseurs secs sont principalement utilisés pour les machines. Le générateur augmente la puissance du moteur à combustion. L'hydrogène s'enflamme beaucoup plus rapidement que le carburant liquide, augmentant la force du piston. En plus de Mole, vous pouvez prendre Mister Muscle, de la soude caustique, du bicarbonate de soude.
Le générateur ne fonctionne pas sur l'eau potable. Il est préférable de connecter l'électricité comme ceci: la première et la dernière plaque - moins, et sur la plaque au milieu - plus. Plus la surface des plaques est grande et plus le courant est fort, plus le gaz est libéré.
Types d'électrolyseurs
Soudage par points de bricolage pour batteries
Selon la conception et le principe de fonctionnement, il existe 5 types d'installations d'électrolyse.
Sécher
Ces électrolyseurs sont constitués d'électrodes à plaques séparées par des joints en caoutchouc scellés. Souvent, les «cellules» de l'installation sont en plus placées dans une enceinte étanche.
L'hydrogène et l'oxygène générés à la suite de l'électrolyse sont évacués par des tuyaux de dérivation spéciaux situés à l'extrémité du corps ou dans les plaques extrêmes de l'installation.
Écoulement
Les installations d'électrolyse de ce type ont le dispositif suivant:
- Bain d'électrolyse (corps) avec deux buses, à travers l'une desquelles un électrolyte y est introduit, à travers le second, le gaz détonant formé à la suite de l'électrolyse est déchargé;
- Electrodes à plaques séparées par des entretoises;
- Un réservoir à électrolyte situé au-dessus du boîtier avec des électrodes et relié par des tuyaux aux tuyaux de dérivation du bain d'électrolyse de l'installation et ayant un tuyau de dérivation avec une vanne de gaz en partie supérieure.
Lors du fonctionnement d'un tel dispositif, le gaz dégagé à travers le tuyau de dérivation et le tuyau pénètre dans le réservoir avec l'électrolyte et, créant une certaine pression dans celui-ci, quitte l'installation par la vanne sur le tuyau de dérivation.
Membrane
Les cellules d'électrolyse de telles installations sont constituées de deux électrodes séparées par une fine membrane qui laisse passer les produits d'électrolyse et sépare les électrodes l'une de l'autre.
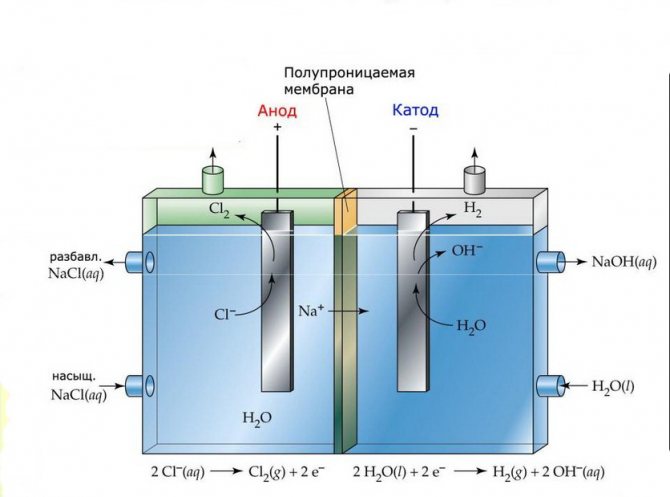

Installation d'électrolyse à membrane
Diaphragme
Les installations d'électrolyse de ce type se composent d'un ballon en forme de "U" avec deux électrodes insérées dans celui-ci et 2-3 membranes imperméables. Des électrolyseurs similaires sont utilisés pour la production séparée d'hydrogène pur et d'oxygène.
Alcalin
Contrairement à d'autres modèles d'électrolyseurs, dans ceux-ci, une solution alcaline est utilisée comme électrolyte - la soude caustique (hydroxyde de sodium), qui n'est pas seulement une source supplémentaire d'hydrogène et d'oxygène, mais également un catalyseur pour l'électrolyse.
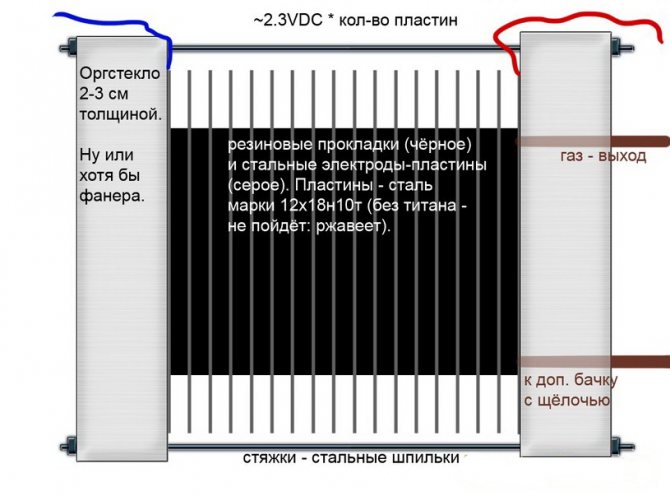

Circuit d'électrolyseur alcalin
De telles installations, contrairement aux analogues d'autres types, permettent l'utilisation d'électrodes moins chères en fer ordinaire.
Faites l'électrolyseur de vos propres mains
Vous connaissez sûrement le processus d'électrolyse du programme de l'école élémentaire. C'est à ce moment que 2 électrodes polaires sont placées dans l'eau sous courant afin d'obtenir des métaux ou des non-métaux sous leur forme pure. Un électrolyseur est nécessaire pour décomposer les molécules d'eau en oxygène et hydrogène. L'électrolyseur, dans le cadre de mécanismes scientifiques, divise les molécules en ions.
Il existe deux types de cet appareil:
- Electrolyseur sec (il s'agit d'une cellule complètement fermée);
- Electrolyseur humide (ce sont deux plaques métalliques placées dans un récipient d'eau).
Cet appareil est simple au niveau de l'appareil, ce qui permet utiliser même à la maison... Les électrolyseurs divisent les charges d'électrolyse des atomes des molécules en atomes chargés.
Dans notre cas, il divise l'eau en hydrogène positif et oxygène négatif. Pour ce faire, une grande quantité d'énergie est nécessaire et pour réduire la quantité d'énergie requise, un catalyseur est utilisé.
Electrolyseur pour la production d'hydrogène
Calcul de la mise à la terre
Afin d'assembler l'électrolyseur le plus simple de vos propres mains, vous pouvez utiliser le dessin illustré sur la figure.
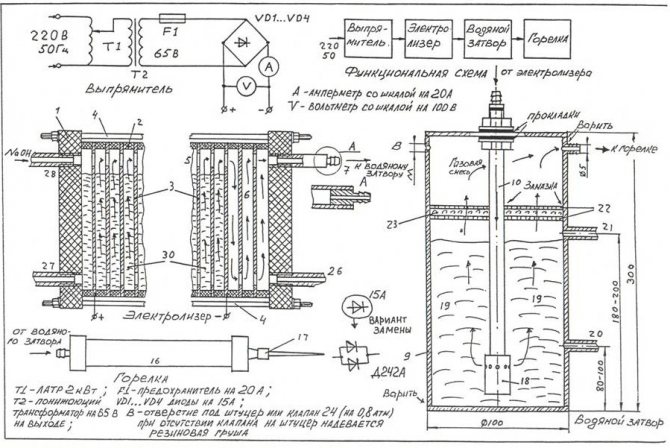

Dessin de l'électrolyseur maison le plus simple
Noter! Un électrolyseur est une installation assez dangereuse, qui, lors du fonctionnement, de l'oxyhydrogène gazeux, s'accumulant en grande quantité, peut provoquer une explosion grave. L'appareil ne doit pas être placé à proximité de sources de feu ouvert, d'appareils de chauffage.
Electrolyseur DIY pour une voiture
Pour améliorer la combustion du carburant dans un moteur de voiture, un électrolyseur est souvent assemblé, composé d'un boîtier d'une ancienne batterie avec des plaques en acier inoxydable placées à l'intérieur, de deux buses, dont l'une est reliée à un réservoir rempli d'électrolyte, la seconde est connecté à un tuyau d'alimentation en air du moteur (plus précisément, avec un ondulé de l'entrée d'air au filtre à air).
Un tel électrolyseur fait maison est alimenté par la batterie de la voiture à l'aide d'un relais et d'un fusible de 10 A.
Nous créons un appareil de nos propres mains
L'appareil pour ce processus peut être fait à la main.
Pour cela, vous aurez besoin de:
- Tôle d'acier inoxydable;
- Boulons M6 x 150;
- Rondelles;
- Des noisettes;
- Tube transparent;
- Éléments de liaison avec filetage des deux côtés;
- Conteneur en plastique d'un litre et demi;
- Filtre à eau;
- Clapet anti-retour pour l'eau.
Une excellente option pour l'acier inoxydable est l'AISI 316L d'un fabricant étranger ou 03X16H15M3 d'un fabricant de notre pays. Il n'est absolument pas nécessaire d'acheter de l'acier inoxydable, vous pouvez prendre l'ancien. 50 à 50 centimètres vous suffisent.
"Pourquoi prendre l'acier inoxydable lui-même?" - tu demandes. Puisque le métal le plus courant se corrode. L'acier inoxydable tolère mieux les alcalis. Devraient esquisser la feuille de manière à la diviser en 16 carrés similaires... Vous pouvez le couper avec une meuleuse d'angle. Dans chaque carré, coupez l'un des coins.
De l'autre côté et dans le coin opposé, à partir du coin scié, percez un trou pour un boulon qui aidera à maintenir les plaques ensemble. L'électrolyseur ne s'arrête pas de fonctionner comme ceci:L'électricité de la plaque s'écoule vers la plaque - et l'eau se décompose en oxygène et hydrogène. Grâce à cela, nous avons besoin d'une bonne plaque négative.
Les plaques doivent être connectées en alternance: plus-moins-plus-moins, avec une méthode similaire, il y aura un fort courant. Pour isoler les plaques une par une, un tube est utilisé. Un anneau est coupé du niveau. En le coupant, on obtient une bande d'un millimètre d'épaisseur. Cette distance est plus correcte pour faire du gaz.
Les plaques sont interconnectées avec des rondelles: nous mettons une rondelle sur le boulon, puis une plaque et trois rondelles, puis une plaque à nouveau, et ainsi de suite. Sur le plus et le moins, huit assiettes doivent être plantées. Si tout est fait correctement, les coupes des plaques ne toucheront pas les électrodes.
Ensuite, vous devez serrer les écrous et isoler les plaques. Ensuite, nous plaçons la structure dans un récipient en plastique.
Présentation des fabricants d'électrolyseurs
Les principaux producteurs d'électrolyseurs sont à la fois des entreprises nationales (RUSAL, NPF RutTech, JSC Uralkhimmash), ainsi que leurs concurrents étrangers - Teledyne Energy Systems, Inc (USA), Hydrogenics Corp. (La Belgique).
Ainsi, l'électrolyseur est une installation assez simple et riche en fonctionnalités utilisée pour produire de l'oxyhydrogène gazeux, qui à l'avenir devrait être utilisé comme carburant pour les moteurs à combustion interne et les chaudières de chauffage.
Électrolyse à domicile à faire soi-même
Quand j'étais petite, j'ai toujours voulu faire quelque chose moi-même, de mes propres mains. Mais les parents (et d'autres personnes proches) dans la plupart des cas ne l'ont pas permis. Et je n’ai pas vu alors (et jusqu’à présent je ne vois rien) de mal quand les petits enfants veulent apprendre ??
Bien sûr, je n'ai pas écrit cet article dans le but de rappeler les expériences de l'enfance dans le désir de commencer l'auto-éducation. Par accident, en surfant sur Internet, je suis tombé sur une question de ce genre. Un petit garçon bombardier a posé des questions sur la façon de faire de l'électrolyse à la maison. C'est vrai, je ne lui ai pas répondu, car ce garçon voulait électrolyser le mélange douloureusement suspect ?? J'ai décidé que je ne dirais pas plus loin du péché, laissez-moi regarder dans les livres moi-même. Mais il n'y a pas si longtemps, en parcourant à nouveau les forums, j'ai vu une question similaire d'un enseignant d'une école de chimie. A en juger par la description, son école est si pauvre qu'elle ne peut pas (ne veut pas) acheter un électrolyseur pour 300 roubles.L'enseignant (quel problème!) N'a pas pu trouver un moyen de sortir de la situation. Alors je l'ai aidé. Pour ceux qui sont curieux de connaître ce genre de produits faits maison, je poste cet article sur le site.
En fait, le processus de production et l'utilisation de notre auto-palette sont très primitifs. Mais je vais vous parler de la sécurité d'abord, et de la fabrication - dans le second. Et le fait est que nous parlons d'un électrolyseur de démonstration, et non d'une installation industrielle. Grâce à cela, pour la sécurité, il sera bon de l'alimenter non pas à partir du réseau, mais à partir de piles AA ou à partir d'une batterie. Naturellement, plus la tension est élevée, plus le processus d'électrolyse se déroulera rapidement. Cependant, pour l'observation visuelle des bulles de gaz, il est assez assez 6 V, mais 220 est déjà excessif. avec une telle tension, l'eau, par exemple, va bouillir le plus vite, et ce n'est pas très sûr ... Eh bien, je pense que vous avez compris la tension?
Parlons maintenant de l'endroit et dans quelles conditions nous allons expérimenter. La toute première chose, ce devrait être soit un espace libre, soit une pièce bien ventilée. Bien que j'ai tout fait dans un appartement avec des fenêtres fermées et rien de tel? Deuxièmement, il vaut mieux faire l'expérience sur une bonne table. Le mot «bon» signifie que la table doit être stable, ou mieux, lourde, rigide et fixée à la surface du sol. Dans ce cas, le revêtement de table doit être résistant aux substances agressives. À propos, la tuile d'une tuile est parfaite pour cela (mais pas toutes, malheureusement). Une table comme celle-ci sera utile non seulement pour cette expérience. Cependant, j'ai tout fait sur un tabouret ordinaire ?? Troisièmement, pendant l'expérience, vous n'avez pas besoin de déplacer la source d'alimentation (dans mon cas, les piles). Pour cette raison, pour plus de fiabilité, il est préférable de les poser immédiatement sur la table et de les réparer afin qu'ils ne bougent pas. Croyez-moi, c'est plus pratique que de les tenir régulièrement avec vos mains. J'ai simplement attaché mes propres piles avec du ruban électrique au premier objet dur que j'ai vu. Quatrièmement, les plats dans lesquels nous allons expérimenter, qu'ils soient petits. Un verre simple s'adapte ou un verre à liqueur. À propos, c'est la façon la plus optimale d'utiliser des lunettes à la maison, par opposition à y verser de l'alcool avec une utilisation ultérieure ...
Eh bien, passons maintenant spécifiquement à l'appareil. Il est fourni dans la figure, mais pour l'instant, je vais expliquer brièvement quoi et quoi.
Nous devons prendre un simple crayon et en retirer l'arbre avec un couteau ordinaire et extraire une mine entière du crayon. Vous pouvez cependant vous inspirer d'un crayon mécanique. Mais il y a deux difficultés à la fois. Le premier est celui habituel. Le plomb d'un crayon mécanique est trop fin, pour nous, cela ne convient tout simplement pas pour une expérience visuelle. La deuxième difficulté est une composition incompréhensible des ardoises actuelles. On a l'impression qu'ils ne sont pas faits de graphite, mais d'autre chose. En général, mon expérience avec un tel "plomb" n'a pas du tout été réussie, même à une tension de 24 V. Grâce à cela, j'ai dû choisir un bon crayon simple et boisé. La tige de graphite résultante nous servira d'électrode. Comme vous pouvez l'imaginer, nous avons besoin de deux électrodes. Grâce à cela, on va chercher le deuxième crayon, ou tout simplement casser la tige existante en deux. J'ai fait ça.
Avec n'importe quel fil à portée de main, nous enroulons la première électrode de plomb (avec une extrémité du fil), et nous connectons ce fil au moins de la source d'alimentation (avec l'autre extrémité). Ensuite, nous prenons la deuxième avance et faisons de même avec. Pour cela, sur cette base, nous avons besoin d'un deuxième fil. Mais dans ce cas, nous connectons ce fil au plus de l'alimentation. Si vous avez des problèmes pour attacher la tige de graphite fragile au fil, vous pouvez utiliser les outils à portée de main, tels que du ruban adhésif ou du ruban adhésif. Si cela n'a pas fonctionné pour envelopper la pointe du graphite avec le fil lui-même et que le ruban adhésif ou le ruban isolant n'a pas fourni un contact étroit, essayez de coller le fil avec de la colle conductrice. Si vous ne l'avez pas, attachez au moins le fil au fil avec un fil. Pas besoin d'avoir peur, le fil ne brûlera pas avec une telle tension ??
Pour ceux qui ne connaissent rien aux batteries et aux règles simples pour les connecter, je vais vous expliquer un peu. La batterie de type doigt produit une tension de 1,5 V. Sur la photo, j'ai deux batteries similaires. De plus, ils sont connectés progressivement - l'un après l'autre, pas en parallèle. Avec une connexion (série) similaire, la tension finale sera résumée à partir de la tension de chaque batterie, c'est-à-dire que pour moi, elle est de 1,5 + 1,5 = 3,0 V. C'est moins que les 6 volts précédemment indiqués. Mais j'étais trop paresseux pour acheter quelques batteries de plus. Principe vous et doit donc être clair ??
Commençons l'expérience. Par exemple, nous nous limiterons à l'électrolyse de l'eau.Premièrement, il est très accessible (j'espère que le lecteur de cet article ne vit pas au Sahara), et deuxièmement, il est inoffensif. De plus, je montrerai comment avec le même appareil (électrolyseur) avec la même substance (eau) pour effectuer deux divers vivre. Je pense que vous avez assez d'imagination pour proposer un tas d'expériences similaires avec d'autres substances ?? En général, l'eau du robinet nous convient. Mais je vous recommande d'en ajouter un peu plus et de le saler. Un peu - cela signifie une petite pincée, pas une cuillère à dessert entière. C'est important! Remuez bien le sel pour le dissoudre. Ainsi, l'eau, étant un diélectrique à l'état pur, conduira parfaitement l'électricité. au début de l'expérience, essuyez la table de l'humidité potentielle, puis placez la source d'alimentation et un verre d'eau dessus.
Nous abaissons les deux électrodes, présentes sous tension, dans l'eau. Dans le même temps, assurez-vous que seul le graphite est immergé dans l'eau et que le fil lui-même ne doit pas toucher l'eau. Le début de l'expérience peut être retardé. Le temps dépend de nombreux indicateurs: de la composition de l'eau, de la qualité des fils, de la qualité du graphite et, bien sûr, de la tension de la source d'alimentation. Le début de ma réaction a été retardé de quelques secondes. L'oxygène commence à évoluer sur l'électrode qui était connectée au plus des batteries. De l'hydrogène sera libéré sur l'électrode connectée au moins. Il est à noter qu'il y a plus de bulles d'hydrogène. De très petites bulles collent autour de la partie du graphite immergée dans l'eau. Ensuite, certaines des bulles commencent à flotter.
Électrode au début de l'expérience. Il n'y a pas encore de bulles de gaz. Bulles d'hydrogène formées sur l'électrode connectée au pôle négatif des batteries
Quelles autres expériences peut-il y avoir? Si vous avez déjà suffisamment joué avec l'hydrogène et l'oxygène, nous procédons à une autre expérience. C'est plus intéressant, surtout pour les chercheurs à domicile. C'est intéressant en ce qu'il est possible non seulement de le voir, mais aussi de le sentir. Dans l'expérience passée, nous avons reçu de l'oxygène et de l'hydrogène, qui, à mon avis, ne sont pas très spectaculaires. Et dans une autre expérience, nous obtenons deux substances (utiles dans la vie de tous les jours, d'ailleurs). au début de l'expérience, arrêtez l'expérience précédente et séchez les électrodes. Maintenant, prenez du sel de table (que vous utilisez habituellement dans la cuisine) et dissolvez-le dans la masse d'eau. Dans ce cas, pas une petite quantité. En fait, une quantité décente de sel est la seule chose qui rend la deuxième expérience différente de la première. Après avoir dissous le sel, vous pouvez immédiatement répéter l'expérience. Maintenant, une réaction différente a lieu. Sur une bonne électrode, ce n'est pas de l'oxygène qui est libéré maintenant, mais du chlore. Et sur le plan négatif, de l'hydrogène est également libéré. Quant au verre dans lequel se trouve la solution saline, de l'hydroxyde de sodium y reste après une électrolyse prolongée. C'est la soude caustique familière, l'alcali.
Le chlore, vous pourrez le sentir. Mais pour le meilleur effet, je recommande de prendre une tension d'au moins 12 V. Sinon, vous risquez de ne pas ressentir l'arôme. La présence d'alcali (après une très longue électrolyse) dans le verre peut être contrôlée de plusieurs manières. Le plus simple et le plus violent est de mettre la main dans le verre. Un présage ethnique dit que si une sensation de brûlure commence, il y a un alcali dans le verre. Le test décisif est une méthode plus intelligente et plus distincte. Si votre école est si pauvre qu'elle n'est même pas en mesure d'acquérir un tournesol, vous serez aidé par des indicateurs pratiques. L'un d'eux, comme on dit, peut servir de goutte de jus de betterave ?? Mais il est tout à fait possible de verser un peu de graisse dans la solution. Autant que je sache, la saponification devrait avoir lieu.
Pour les plus curieux, je décrirai ce qui s'est réellement passé lors des expériences. Dans la première expérience, sous l'influence d'un courant électrique, une réaction similaire a eu lieu: 2 H2O >>> 2 H2 + O2 Les deux gaz flottent naturellement de l'eau à la surface. À propos, les gaz flottants peuvent être piégés. Serez-vous capable de le faire vous-même?
Dans une autre expérience, la réaction était complètement différente.Il a également été initié par un courant électrique, mais maintenant non seulement l'eau, mais aussi le sel a agi comme réactifs: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Gardez à l'esprit que la réaction doit avoir lieu dans un excès d'eau. Pour savoir quelle quantité de sel est considérée comme la plus grande, vous pouvez la compter à partir de la réaction ci-dessus. Vous pouvez toujours réfléchir à la manière d'améliorer l'appareil ou aux autres expériences qui peuvent être effectuées. En effet, il est possible que l'hypochlorite de sodium puisse être obtenu par électrolyse. Dans des conditions de laboratoire, dans la plupart des cas, il est obtenu par passage de chlore gazeux dans une solution d'hydroxyde de sodium.