En av de mange fysisk-kjemiske prosessene som har funnet bred anvendelse, både i industrien og i hverdagen, er elektrolyse - valget på overflatene til elektroder som er koblet til en strømkilde plassert i en løsning eller smelte, deres komponenter (rent metall - aluminium, kobber, gass osv.). Hovedinstallasjonen der denne prosessen foregår er en elektrolysator.

Elektrolysator
Hva er en elektrolysator
En elektrolysator er en spesiell installasjon som brukes til å skille bestanddelene fra en løsning eller smelte.
Hovedegenskapene til elektrolysøren er:
- Driftsspenningen for en elektrode varierer fra 1,8 til 2,0 V;
- Strømstyrke - for det normale løpet av elektrolyseprosessen tilføres en strøm til elektrodene med en verdi av denne karakteristikken fra 5 til 10 A;
- Antall elektroder - minimum antall elektroder er 2, maksimalt er begrenset av størrelsen på selve installasjonen og dens formål;
- Dimensjoner på elektroder - ikke karbonstenger brukes som elektroder, men metallplater, hvis størrelse bestemmes av formålet med installasjonen, strømspenningskarakteristikken til strømmen som tilføres platene;
- Avstand mellom motsatt ladede elektrodeoverflater - minimumsavstanden mellom elektrodeplatene må være minst 1,5 mm;
- Elektrodemateriale - I moderne elektrolysatorer brukes rustfritt stålplate med nikkel som materiale for anoden og katoden.
Også en annen viktig egenskap ved et elektrolyseanlegg er bruken av katalysatorer.
Slike installasjoner brukes til følgende formål:
- Å skaffe en oxyhydrogengass, bestående av en blanding av hydrogen og oksygen (Browns gass);
- Isolering av rent aluminium, magnesium, sink fra salt smelter;
- Rensing av vann fra salter og urenheter oppløst i det;
- Påføring av et tynt lag med nikkel, sink som forhindrer korrosjon på overflaten av metalldeler;
- Desinfeksjon av matvarer;
- Rensing av avløpsvann fra oppløste salter av tungmetaller og andre skadelige stoffer.
Viktig! Platina-elektrode laget av vanlig jern brukes sjeldnere i elektrolyseinstallasjoner enn fra rustfritt stål, siden den oksiderer raskere og blir ubrukelig.
Selvlaget elektrolysator
Alle kan lage en elektrolysator med egne hender. For monteringsprosessen av det vanligste designet, vil følgende materialer være nødvendig:
- rustfritt stålplate (de beste alternativene er utenlandske AISI 316L eller vår 03X16H15M3);
- bolter М6х150;
- skiver og nøtter;
- gjennomsiktig rør - du kan bruke et vater, som brukes til konstruksjonsformål;
- flere fiskebeinsbeslag med en ytre diameter på 8 mm;
- plastbeholder med et volum på 1,5 liter;
- et lite filter som filtrerer vann fra springen, for eksempel et filter for vaskemaskiner;
- tilbakeslagsventil.
Monteringsprosess
Samle elektrolysatoren med egne hender i henhold til følgende instruksjoner:
- Først og fremst må du merke og påfølgende saging av rustfritt stålplate i identiske firkanter. Saging kan gjøres med en vinkelsliper (vinkelsliper). Ett av hjørnene i slike firkanter må kuttes i en vinkel for å sikre platene riktig;
- Deretter må du lage et hull for bolten på siden av platen motsatt hjørnesagkuttet;
- Tilkoblingen av platene skal gjøres etter tur: en plate på "+", den neste på "-" og så videre;
- Mellom de forskjellige ladede platene skal det være en isolator som fungerer som et rør fra vater.Den skal kuttes i ringer, som skal kuttes i lengderetningen for å få striper med 1 mm tykkelse. Denne avstanden mellom platene er tilstrekkelig for god gassutvikling under elektrolyse;
- Platene festes sammen ved bruk av skiver som følger: en skive sitter på bolten, deretter en plate, deretter tre skiver, etter en plate og så videre. Plater, gunstig ladet, plasseres i et speilbilde av negativt ladede ark. Dette gjør det mulig å forhindre at de sagede kantene berører elektrodene;


Plater av elektrolyseanlegget samlet
- Når du monterer platene, bør du isolere dem samtidig og stramme mutrene.
- Dessuten må hver plate ringes for å være sikker på at det ikke er kortslutning.
- Videre må hele forsamlingen plasseres i en plastboks;
- Etter det er det verdt å markere stedene der boltene berører containerens vegger, hvor du borer to hull. Hvis boltene ikke passer inn i beholderen, må de kuttes med baufil;
- Deretter strammes boltene med muttere og skiver for å tette strukturen;


Plater plassert i en plastbeholder
- Etter at trinnene er tatt, må du lage hull i beholderlokket og sette inn beslagene i dem. Ugjennomtrengelighet i dette tilfellet kan sikres ved å tette skjøtene med silikonbaserte tetningsmasser;
- En sikkerhetsventil og et filter i konstruksjonen er plassert ved utløpet av gassen og fungerer som et middel for å kontrollere overdreven opphopning av gass, noe som kan føre til dårlige resultater;
- Elektrolyseenheten er montert.
Den siste fasen er en test som utføres på en lignende måte:
- fylle beholderen med vann opp til merket for boltene for festene;
- koble strøm til enheten;
- tilkobling til rørets montering, hvor den motsatte enden senkes ned i vannet.
Hvis en svak strøm tilføres installasjonen, vil utslipp av gass gjennom røret være nesten umerkelig, men det vil være mulig å se på det fra innsiden av elektrolysatoren. Ved å øke vekselstrømmen, tilsette en alkalisk katalysator til vannet, kan gassutbyttet økes betydelig.
Den produserte elektrolysatoren er som regel en viktig del av mange enheter, for eksempel en hydrogenbrenner.


utseendet til en hydrogenbrenner, hvis grunnlag anses å være en egenprodusert elektrolysator
Når du kjenner til typene, nøkkelegenskapene, enheten og arbeidsprinsippet til ioniske installasjoner, kan du utføre riktig montering av en hjemmelaget struktur, som er en utmerket assistent i en rekke hverdagssituasjoner: fra sveising og sparing av drivstofforbruk til motorvogner til funksjonen til varmesystemer.
Enhet og driftsprinsipp
Katode og anode
Det enkleste elektrolyseanlegget består av flere "celler", som hver inkluderer:
- 2 plateelektroder - katode (negativ) og anode (positiv);
- En gummipakning rundt omkretsen av to tilstøtende forskjellige elektroder.
De ytre cellene er utstyrt med spesielle rør som de utviklede gassene slippes ut gjennom.
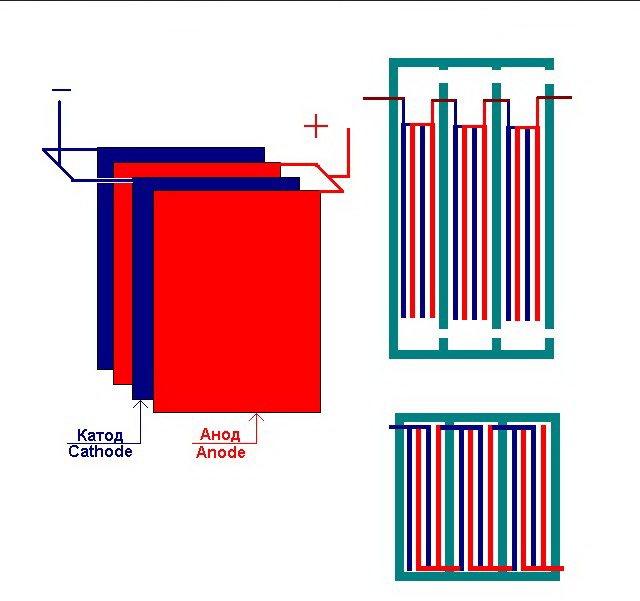

Flere sammenkoblede "celler" i elektrolyseanlegget
Elektrolysatoren kan inneholde fra 1 til 30-40 eller flere slike "celler", platene med samme navn er koblet i serie.
Viktig! Når du bruker strømforsyninger med vekselstrøm, benyttes i tillegg likerettere, den enkleste er en diodebro.
En slik installasjon fungerer som følger:
- Destillert vann med alkali oppløst i det eller vanlig natron helles i rommet mellom elektrodene;
- En spenning på 1,8-2,0 V tilføres fra strømforsyningen til elektrodene til alle cellene i installasjonen;
- Som et resultat av elektrolyseprosessen tiltrekkes anioner (positivt ladede ioner) av et stoff oppløst i vann til den negativt ladede katoden, som et resultat av at det dannes en tynn natriumfilm på den;
- På en positivt ladet anode skjer ødeleggelsen av vannmolekyler, med hvert dannet 2 hydrogenatomer og 1 oksygenatom;
- Den frigjorte detonerende gassen gjennom grenrørene kommer inn i beholderen som er beregnet for den.
Intensiteten til elektrolyseprosessen avhenger av spenningen og strømstyrken - ved lave verdier av disse egenskapene vil prosessen ikke fortsette. Hvis strømkilden forsyner en strøm med for høye verdier av strømspenningskarakteristikken, vil løsningen som helles i elektrolysatoren være veldig varm og koke bort.
Feilsøking og testing av enheten
Da er det nødvendig å bestemme hvor boltene berører boksens vegger og bor på disse stedene to hull. Hvis det uten tilsynelatende grunn viser seg at boltene ikke passer inn i beholderen, bør de gjøre det kutt og stram for tetthet med muttere... Nå må du bore ut lokket og sette inn de gjengede kontaktene der fra begge sider. For å sikre ugjennomtrengelighet, bør skjøten forsegles med et silikonbasert tetningsmiddel.
Etter å ha satt sammen din egen elektrolysator med egne hender, bør du teste den. For å gjøre dette må du koble enheten til en strømkilde, fyll den med vann til boltene, sett på lokket ved å koble et rør til beslaget og senke den motsatte enden av røret i vannet. Hvis strømmen er svak, vil strømmen være synlig fra innsiden av elektrolysatoren.
Øk strømmen gradvis i hjemmelaget apparat. Destillert vann leder ikke strøm godt fordi det ikke inneholder salter eller urenheter. For å forberede elektrolytten er det nødvendig å tilsette alkali i vannet. For å gjøre dette må du ta natriumhydroksid (inneholdt i midler for rengjøring av rør som "Mole"). En sikkerhetsventil er nødvendig for å forhindre at en anstendig mengde gass akkumuleres.
- Det er bedre å bruke destillert vann og brus som katalysator.
- Du bør blande noe av natron med førti deler vann. Veggene på sidene er best laget av akrylglass.
- Elektrodene er best laget av rustfritt stål. Det er fornuftig å bruke gull til plater.
- Bruk gjennomsiktig PVC som bakside. De kan være 200 x 160 millimeter store.
- Du kan bruke din egen elektrolysator, laget av deg selv, til å lage mat, for full forbrenning av bensin i biler og i de fleste tilfeller.
Tørre elektrolysatorer brukes hovedsakelig til maskiner. Generatoren øker kraften til forbrenningsmotoren. Hydrogen antennes mye raskere enn flytende drivstoff, noe som øker kraften til stempelet. I tillegg til Mole kan du ta Mister Muscle, kaustisk brus, natron.
Generatoren fungerer ikke på drikkevann. Det er bedre å koble strøm slik: den første og den siste platen - minus, og på platen i midten - pluss. Jo større areal på platene og jo sterkere strøm, jo mer gass frigjøres.
Typer elektrolysatorer
DIY punkt sveising for batterier
Avhengig av utforming og driftsprinsipp, er det 5 typer elektrolyseanlegg.
Tørke
Disse elektrolysatorene består av plateelektroder skilt av forseglede gummipakninger. Ofte plasseres "cellene" i installasjonen i tillegg i et lukket kabinett.
Hydrogen og oksygen som genereres som et resultat av elektrolyse, fjernes gjennom spesielle grenrør som er plassert på enden av kroppen eller i de ekstreme platene til installasjonen.
Flyter
Elektrolyseinstallasjoner av denne typen har følgende enhet:
- Et elektrolysebad (legeme) med to dyser, gjennom hvilken den ene mates elektrolytt inn i den, gjennom det andre utløses den detonerende gassen som dannes som et resultat av elektrolyse;
- Plateelektroder atskilt med avstandsstykker;
- En tank med elektrolytt plassert over huset med elektroder og forbundet med slanger til grenrørene til elektrolysebadet til installasjonen og med et grenrør med en gassventil i øvre del.
Under driften av en slik innretning kommer den utviklede gassen gjennom grenrøret og slangen inn i tanken med elektrolytten, og skaper et visst trykk i den, forlater installasjonen gjennom ventilen på grenrøret.
Membran
Elektrolysecellene til slike installasjoner består av to elektroder skilt av en tynn membran som gjør at elektrolyseprodukter kan passere og skiller elektrodene fra hverandre.
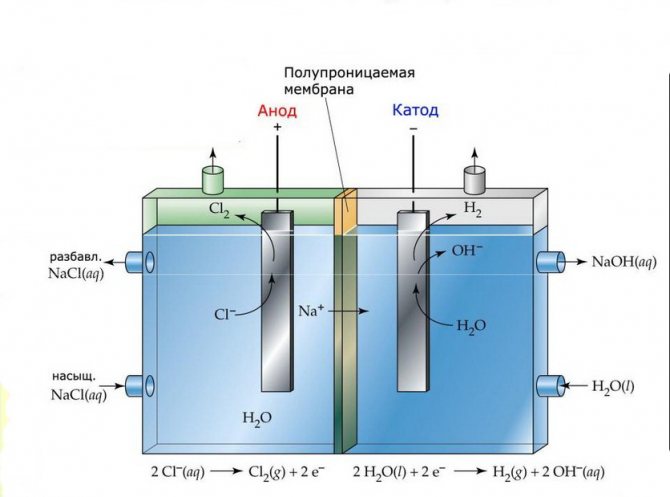

Membranelektrolyseanlegg
Membran
Elektrolyseinstallasjoner av denne typen består av en "U" -formet kolbe med to elektroder satt inn i den og 2-3 ugjennomtrengelige membraner. Lignende elektrolysatorer brukes til separat produksjon av rent hydrogen og oksygen.
Alkalisk
I motsetning til andre modeller av elektrolysatorer, i disse brukes en alkaliløsning som en elektrolytt - kaustisk soda (natriumhydroksid), som ikke bare er en ekstra kilde til hydrogen og oksygen, men også en katalysator for elektrolyse.
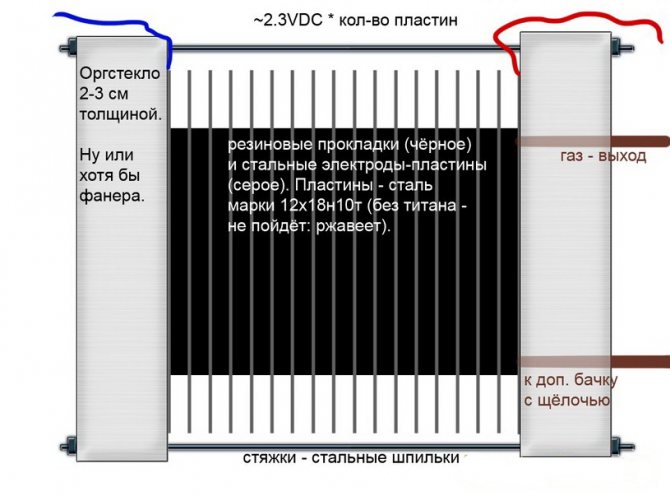

Alkalisk elektrolysekrets
Slike installasjoner, i motsetning til analoger av andre typer, tillater bruk av billigere elektroder laget av vanlig jern.
Gjør elektrolysøren med egne hender
Sikkert, du er kjent med elektrolyseprosessen fra grunnskolens læreplan. Dette er når to polære elektroder plasseres i vann under strøm for å oppnå metaller eller ikke-metaller i sin rene form. En elektrolysator er nødvendig for å spalte vannmolekyler i oksygen og hydrogen. Elektrolysøren deler, som en del av vitenskapelige mekanismer, molekyler i ioner.
Det er to typer av denne enheten:
- Tørr elektrolysator (dette er en helt lukket celle);
- Våt elektrolysator (dette er to metallplater plassert i en beholder med vann).
Denne enheten er enkel når det gjelder enheten, noe som gjør det mulig bruk selv hjemme... Elektrolysatorer deler elektrolyseladningene til molekylenes atomer i ladede atomer.
I vårt tilfelle deler den vann i positivt hydrogen og negativt oksygen. For å gjøre dette kreves det en stor mengde energi, og for å gjøre mindre av den nødvendige mengden energi brukes en katalysator.
Elektrolysator for hydrogenproduksjon
Jordingsberegning
For å montere den enkleste elektrolysatoren med egne hender, kan du bruke tegningen vist på figuren.
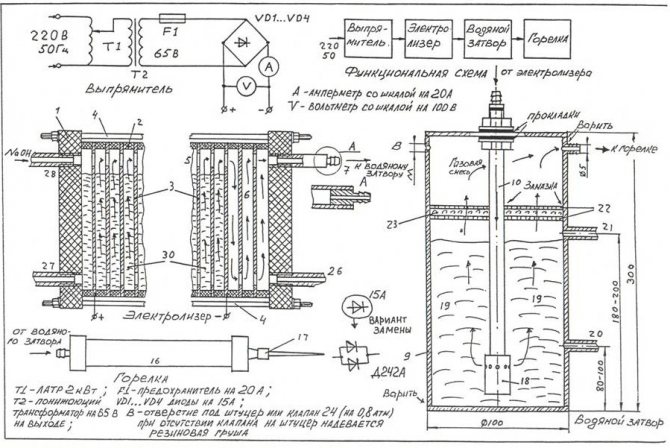

Tegning av den enkleste hjemmelagde elektrolysatoren
Merk! En elektrolysator er en ganske farlig installasjon, som oksygenhydrogengass, som akkumuleres i store mengder, under drift kan forårsake en alvorlig eksplosjon. Enheten skal ikke plasseres i nærheten av kilder til åpen ild, varmeenheter.
DIY elektrolysør for en bil
For å forbedre forbrenningen av drivstoff i en bilmotor blir det ofte montert en elektrolysator bestående av en koffert fra et gammelt batteri med rustfritt stålplater plassert inne, to dyser, hvorav den ene er koblet til en tank fylt med elektrolytt, den andre er koblet til en lufttilførselsslange til motoren (nærmere bestemt med en bølgepapp fra luftinntaket til luftfilteret).
En slik hjemmelaget flytende elektrolyser drives av bilens batteri ved hjelp av et relé og en 10 A sikring.
Vi lager en enhet med egne hender
Enheten for denne prosessen kan gjøres for hånd.
For dette trenger du:
- Rustfritt stål ark;
- Bolter M6 x 150;
- Skiver;
- Nøtter;
- Gjennomsiktig rør;
- Koblingselementer med tråd på begge sider;
- En og en halv liter plastbeholder;
- Vannfilter;
- Sjekk ventilen for vann.
Et utmerket alternativ for rustfritt stål er AISI 316L fra en utenlandsk produsent eller 03X16H15M3 fra en produsent fra vårt land. Det er absolutt ikke behov for å kjøpe rustfritt stål, du kan ta den gamle. 50 til 50 centimeter er nok for deg.
"Hvorfor ta rustfritt stål selv?" - du spør. Siden det vanligste metallet korroderer. Rustfritt stål tåler alkalier bedre. Bør skissere arket på en slik måte at det deles i 16 lignende firkanter... Du kan kutte den med en vinkelsliper. Klipp ett av hjørnene i hver firkant.
På den andre siden og motsatt hjørne, fra det sagede hjørnet, bor du et hull for en bolt som hjelper til med å holde platene sammen. Elektrolysatoren slutter ikke å virke slik:t plate strømmer til platen - og vann brytes ned i oksygen og hydrogen. Takket være dette trenger vi en god og negativ plate.
Platene må kobles vekselvis: pluss-minus-pluss-minus, med en lignende metode, vil det være en sterk strøm. For å isolere platene en fra en, brukes et rør. En ring er kuttet fra nivået. Ved å kutte den får vi en stripe millimeter tykk. Denne avstanden er mer korrekt for å lage gass.
Platene er sammenkoblet med skiver: vi setter en skive på bolten, deretter en plate og tre skiver, deretter en plate igjen og så videre. På pluss og minus må åtte plater plantes. Hvis alt er gjort riktig, vil ikke kuttene på platene ikke berøre elektrodene.
Deretter må du stramme mutrene og isolere platene. Deretter plasserer vi strukturen i en plastbeholder.
Oversikt over produsenter av elektrolysatorer
De viktigste produsentene av elektrolysører er begge innenlandske foretak (RUSAL, NPF RutTech, JSC Uralkhimmash), så vel som deres utenlandske konkurrenter - Teledyne Energy Systems, Inc (USA), Hydrogenics Corp. (Belgia).
Dermed er elektrolysatoren en ganske enkel og funksjonsrik installasjon som brukes til å produsere oksyhydrogengass, som i fremtiden er planlagt å brukes som drivstoff for forbrenningsmotorer og varmekjeler.
Gjør-det-selv hjemme-elektrolyse
Da jeg var liten, ville jeg alltid gjøre noe selv, med egne hender. Men foreldrene (og andre nære mennesker) tillot i de fleste tilfeller ikke dette. Og jeg så ikke den gangen (og til nå ser jeg ikke) noe dårlig når små barn vil lære ??
Selvfølgelig skrev jeg ikke denne artikkelen for å huske barndomsopplevelser i ønsket om å starte egenopplæring. Bare ved et uhell, da jeg surfer på Internett, kom jeg over et spørsmål av denne typen. En liten bombergutt stilte spørsmål om hvordan man gjør elektrolyse hjemme. Riktignok svarte jeg ikke ham, for denne gutten ville elektrolysere den smertefullt mistenkelige blandingen ?? Jeg bestemte meg for at jeg ikke ville si lenger ut av synd, la meg selv se i bøker. Men for ikke så lenge siden, igjen vandrende gjennom fora, så jeg et lignende spørsmål fra en lærer ved en kjemiskole. Ut fra beskrivelsen å dømme er skolen hans så dårlig at den ikke kan (vil) kjøpe en elektrolysør for 300 rubler. Læreren (for et problem!) Fant ikke en vei ut av situasjonen. Så jeg hjalp ham. For de som er nysgjerrige på denne typen hjemmelagde produkter, legger jeg ut denne artikkelen på nettstedet.
Egentlig er produksjonsprosessen og bruken av vår egenpall veldig primitiv. Men jeg vil fortelle deg om sikkerhet først og om produksjon - i det andre. Og poenget er at vi snakker om en demonstrasjonselektrolysator, og ikke om et industrianlegg. Takket være dette, for sikkerhet, vil det være bra å drive det ikke fra nettverket, men fra AA-batterier eller fra et batteri. Jo høyere spenning, jo raskere vil elektrolyseprosessen gå. Men for visuell observasjon av gassbobler er det ganske nok 6 V., men 220 er allerede overdreven. med en slik spenning vil vann for eksempel koke raskest, og dette er ikke veldig trygt ... Vel, jeg tror du fant ut spenningen?
La oss nå snakke om hvor og under hvilke forhold vi vil eksperimentere. Det aller første, det skal være enten ledig plass eller et godt ventilert rom. Selv om jeg gjorde alt i en leilighet med lukkede vinduer og ingenting som? For det andre gjøres eksperimentet best på et godt bord. Ordet "god" betyr at bordet må være stabilt, eller bedre, tungt, stivt og festet til gulvflaten. I dette tilfellet må borddekningen være motstandsdyktig mot aggressive stoffer. Forresten, fliser fra en flis er perfekte for dette (men ikke alle, dessverre). Et bord som dette vil være nyttig ikke bare for denne opplevelsen. Imidlertid gjorde jeg alt på en vanlig krakk ?? For det tredje trenger du ikke å flytte strømkilden (i mitt tilfelle batterier) under eksperimentet. På grunn av dette, for pålitelighet, er det best å umiddelbart legge dem på bordet og fikse dem slik at de ikke spretter. Tro meg, dette er mer praktisk enn å holde dem regelmessig med hendene. Jeg bandt ganske enkelt mine egne batterier med elektrisk tape til den første harde gjenstanden jeg så. For det fjerde, retter vi vil eksperimentere i, la dem være små. Et enkelt glass passer eller et glass. Forresten, dette er den mest optimale måten å bruke briller hjemme, i motsetning til å helle alkohol i dem med videre bruk ...
Vel, nå la oss gå spesifikt til enheten. Det er gitt i figuren, men foreløpig vil jeg kort forklare hva og hva.
Vi må ta en enkel blyant og fjerne treet fra den med en vanlig kniv og få en hel bly ut av blyanten. Du kan imidlertid ta en ledelse fra en mekanisk blyant. Men det er to vanskeligheter samtidig. Den første er den vanlige. Ledningen fra en mekanisk blyant er for tynn, for oss er dette ganske enkelt ikke egnet for et visuelt eksperiment. Den andre vanskeligheten er en eller annen uforståelig sammensetning av dagens skifer. Det føles som om de ikke er laget av grafitt, men av noe annet. Generelt var min erfaring med en slik "bly" ikke vellykket i det hele tatt, selv ikke med en spenning på 24 V. Takket være dette måtte jeg plukke ut en god treaktig blyant. Den resulterende grafittstangen vil tjene som en elektrode for oss. Som du kan forestille deg, trenger vi to elektroder. Takket være dette velger vi den andre blyanten, eller bare bryter den eksisterende stangen i to. Jeg gjorde faktisk dette.
Med hvilken som helst ledning som kommer til hånden, vikler vi inn den første blyelektroden (med den ene enden av ledningen), og vi kobler denne ledningen til minus av strømkilden (med den andre enden). Så tar vi andre ledelsen og gjør det samme med det. For dette, basert på dette, trenger vi en ny ledning. Men i dette tilfellet kobler vi denne ledningen til pluss strømforsyningen. Hvis du har problemer med å feste den skjøre grafittstangen til ledningen, kan du bruke verktøyene for hånden, for eksempel tape eller tape. Hvis det ikke fungerte å pakke inn spissen av grafitten med selve ledningen, og båndet eller isolasjonsbåndet ikke ga en tett kontakt, prøv å lim ledningen med ledende lim. Hvis du ikke har dette, så bind i det minste ledningen til ledningen med en tråd. Ingen grunn til å være redd, tråden vil ikke brenne ut av en slik spenning ??
For de som ikke vet noe om batterier og de enkle reglene for tilkobling, vil jeg forklare litt. Fingerbatteriet produserer en spenning på 1,5 V. På bildet har jeg to lignende batterier. Videre er de koblet sammen gradvis - den ene etter den andre, ikke parallelt. Med en lignende (seriell) tilkobling vil den endelige spenningen bli oppsummert fra spenningen til hvert batteri, det vil si for meg er den 1,5 + 1,5 = 3,0 V. Dette er mindre enn de tidligere oppgitte 6 volt. Men jeg var for lat til å kjøpe noen flere batterier. Prinsippet du og så må være tydelig ??
La oss starte eksperimentet. For eksempel vil vi begrense oss til elektrolyse av vann.For det første er den veldig tilgjengelig (jeg håper at leseren av denne artikkelen ikke bor i Sahara), og for det andre er den ufarlig. Videre vil jeg vise hvordan med samme enhet (elektrolysator) med samme stoff (vann) for å utføre to diverse erfaring. Jeg tror at du har nok fantasi til å komme med en haug med lignende eksperimenter med andre stoffer ?? Generelt er vann fra springen egnet for oss. Men jeg anbefaler at du tilsetter litt mer av det og salter det. En liten bit - dette betyr en liten klype, ikke en hel dessertskje. Dette er viktig! Rør saltet godt for å løse det opp. Så vann, som er et dielektrikum i ren tilstand, vil perfekt lede strøm. ved begynnelsen av eksperimentet, tørk av bordet fra potensiell fuktighet, og sett deretter strømkilden og et glass vann på den.
Vi senker begge elektrodene, som er til stede under spenning, i vannet. På samme tid må du sørge for at bare grafitt er nedsenket i vannet, og at ledningen ikke berører vannet. Begynnelsen på eksperimentet kan være forsinket. Tiden avhenger av mange indikatorer: av sammensetningen av vannet, kvaliteten på ledningene, kvaliteten på grafitten og selvfølgelig spenningen til strømkilden. Begynnelsen på reaksjonen min ble forsinket i et par sekunder. Oksygen begynner å utvikle seg på elektroden som var koblet til pluss batteriene. Hydrogen frigjøres på elektroden som er koblet til minus. Det skal bemerkes at det er flere hydrogenbobler. Svært små bobler stikker rundt den delen av grafitten som er nedsenket i vannet. Så begynner noen av boblene å flyte.
Elektrode i begynnelsen av eksperimentet. Det er ingen gassbobler ennå. Hydrogenbobler dannet på elektroden koblet til batteriets minuspol
Hvilke andre eksperimenter kan det være? Hvis du allerede har spilt nok med hydrogen og oksygen, fortsetter vi til et nytt eksperiment. Det er mer interessant, spesielt for hjemmeforskere. Det er interessant fordi det er mulig ikke bare å se det, men også å lukte det. Tidligere opplevde vi at vi fikk oksygen og hydrogen, som etter min mening ikke er veldig spektakulære. Og i et annet eksperiment får vi to stoffer (forresten nyttige i hverdagen). ved begynnelsen av eksperimentet, stopp det forrige eksperimentet og tørk elektrodene. Ta nå bordsalt (som du bruker i de fleste tilfeller i kjøkkenrommet) og oppløs det i vannmassen. I dette tilfellet ikke en liten mengde. Egentlig er en anstendig mengde salt det eneste som gjør den andre opplevelsen annerledes enn den første. Etter at saltet er oppløst, kan du umiddelbart gjenta eksperimentet. Nå finner en annen reaksjon sted. På en god elektrode er det ikke oksygen som frigjøres nå, men klor. Og negativt frigjøres også hydrogen. Når det gjelder glasset der saltoppløsningen er plassert, forblir natriumhydroksid i det etter langvarig elektrolyse. Dette er den kjente kaustiske brusen, alkali.
Klor, du vil kunne lukte det. Men for best effekt anbefaler jeg å ta en spenning på minst 12 V. Ellers føler du kanskje ikke aromaen. Tilstedeværelsen av alkali (etter en veldig lang elektrolyse) i glasset kan kontrolleres på flere måter. Det enkleste og mest voldelige er å legge hånden i glasset. Et etnisk varsel sier at hvis en brennende følelse begynner, er det alkali i glasset. En smartere og mer tydelig måte er lakmusprøven. Hvis skolen din er så dårlig at den ikke en gang kan skaffe seg lakmus, vil du bli hjulpet av praktiske indikatorer. En av disse, som de sier, kan tjene som en dråpe betejuice ?? Men det er fullt mulig å bare dryppe litt fett i løsningen. Så vidt jeg vet, bør forsønning finne sted.
For de veldig nysgjerrige vil jeg beskrive hva som faktisk skjedde under eksperimentene. I det første eksperimentet, under påvirkning av en elektrisk strøm, fant en lignende reaksjon sted: 2 H2O >>> 2 H2 + O2 Begge gassene flyter naturlig fra vannet til overflaten. Forresten, flytende gasser kan bli fanget. Kan du gjøre det selv?
I et annet eksperiment var reaksjonen en helt annen.Det ble også initiert av en elektrisk strøm, men nå fungerte ikke bare vann, men også salt som reagenser: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Husk at reaksjonen må finne sted i et overskudd av vann. For å finne ut hvilken mengde salt som regnes som den største, kan du telle det fra reaksjonen ovenfor. Du kan også tenke på hvordan du kan forbedre enheten eller hvilke andre eksperimenter som kan gjøres. Det er faktisk mulig at natriumhypokloritt kan oppnås ved elektrolyse. Under laboratorieforhold oppnås det i de fleste tilfeller ved å føre gassformig klor gjennom en natriumhydroksydoppløsning.