En av de många fysikalisk-kemiska processerna som har funnits bred tillämpning, både inom industrin och i vardagen, är elektrolys - valet på ytorna av elektroder anslutna till en strömkälla placerad i en lösning eller smälta, deras komponenter (ren metall - aluminium, koppar, gas etc.). Huvudinstallationen inom vilken denna process äger rum är en elektrolysator.

Elektrolysator
Vad är en elektrolysator
En elektrolysator är en speciell installation som används för att separera dess beståndsdelar från en lösning eller smälta.
De viktigaste egenskaperna hos elektrolysorn är:
- Driftspänningen för en elektrod sträcker sig från 1,8 till 2,0 V;
- Strömstyrka - för det normala förloppet av elektrolysprocessen matas en ström till elektroderna med ett värde av denna egenskap från 5 till 10 A;
- Antal elektroder - det minsta antalet elektroder är 2, det maximala begränsas av storleken på själva installationen och dess syfte;
- Elektrodernas mått - inte kolstänger används som elektroder, utan metallplattor vars storlek bestäms av installationens syfte, strömspänningskaraktäristiken för strömmen som tillförs plattorna;
- Avstånd mellan motsatt laddade elektrodytor - minimiavståndet mellan elektrodplattorna måste vara minst 1,5 mm;
- Elektrodmaterial - i moderna elektrolysatorer används rostfritt stålplåt med nickel som material för anoden och katoden.
En annan viktig egenskap hos en elektrolysanläggning är användningen av katalysatorer.
Sådana installationer används för följande ändamål:
- Erhålla en oxivätegas, bestående av en blandning av väte och syre (Browns gas);
- Isolering av rent aluminium, magnesium, zink från deras salt smälter;
- Rening av vatten från salter och föroreningar upplösta i det;
- Applicering av ett tunt lager nickel, zink som förhindrar korrosion på metalldelarnas yta;
- Desinfektion av livsmedelsprodukter;
- Rening av avloppsvatten från upplösta salter av tungmetaller och andra skadliga ämnen.
Viktig! Platinaelektroder gjorda av vanligt järn används mindre ofta i elektrolysanläggningar än från rostfritt stål, eftersom det oxiderar snabbare och blir oanvändbart.
Självgjord elektrolysator
Vem som helst kan göra en elektrolysator med egna händer. För monteringsprocessen av den vanligaste konstruktionen behövs följande material:
- rostfritt stålplåt (de bästa alternativen är utländska AISI 316L eller vår 03X16H15M3);
- bultar М6х150;
- brickor och muttrar;
- transparent rör - du kan använda en vattenpass som används för konstruktionsändamål;
- flera sillbenbeslag med en ytterdiameter på 8 mm;
- plastbehållare med en volym på 1,5 liter;
- ett litet filter som filtrerar kranvatten, till exempel ett filter för tvättmaskiner;
- backventilventil.
monteringsprocessen
Samla elektrolysatorn med egna händer enligt följande instruktioner:
- Först och främst måste du markera och därefter såga rostfritt stålplåt i identiska rutor. Sågning kan göras med en vinkelslip (vinkelslip). Ett av hörnen i sådana rutor måste skäras i en vinkel för att fixera plattorna korrekt;
- Därefter måste du göra ett hål för bulten på sidan av plattan mittemot hörnsågsnittet;
- Anslutningen av plattorna ska göras i tur och ordning: en platta på "+", nästa på "-" och så vidare;
- Mellan de olika laddade plattorna ska det finnas en isolator som fungerar som ett rör från vattenpasset.Den ska skäras i ringar, som ska skäras i längdriktningen för att få remsor av 1 mm tjocklek. Detta avstånd mellan plattorna är tillräckligt för god gasutveckling under elektrolys;
- Plattorna fästes ihop med brickor enligt följande: en brickan sitter på bulten, sedan en tallrik, sedan tre brickor, efter en tallrik och så vidare. Plattor, laddade med fördel, placeras i en spegelbild av negativt laddade ark. Detta gör det möjligt att förhindra att de sågade kanterna berör elektroderna;


Plattor från elektrolysanläggningen monterade ihop
- När du monterar plattorna ska du samtidigt isolera dem och dra åt muttrarna.
- Dessutom måste varje platta ringas för att vara säker på att det inte finns någon kortslutning.
- Vidare måste hela enheten placeras i en plastlåda;
- Därefter är det värt att markera de platser där bultarna rör vid behållarväggarna, där du borrar två hål. Om bultarna inte passar in i behållaren måste de skäras med en bågfil.
- Sedan dras bultarna med muttrar och brickor för att täta strukturen;


Plattor placerade i en plastbehållare
- Efter stegen måste du göra hål i behållarens lock och sätta in beslagen i dem. I detta fall kan ogenomtränglighet säkerställas genom att täta fogarna med silikonbaserade tätningsmedel;
- En säkerhetsventil och ett filter i strukturen är placerade vid gasutloppet och fungerar som ett medel för att kontrollera överdriven ansamling av gas som kan leda till dåliga resultat;
- Elektrolysenheten är monterad.
Det sista steget är ett test som utförs på liknande sätt:
- fylla behållaren med vatten upp till märket på skruvarna för fästanordningar;
- ansluta ström till enheten;
- anslutning till rörets montering, vars motsatta ände sänks ned i vattnet.
Om en svag ström appliceras på installationen kommer utsläppet av gas genom röret att vara nästan omärkbart, men det kommer att vara möjligt att titta på det inifrån elektrolysatorn. Genom att öka växelströmmen, tillsätta en alkalisk katalysator till vattnet är det möjligt att avsevärt öka utbytet av den gasformiga substansen.
Den tillverkade elektrolysatorn är som regel en viktig del av många enheter, till exempel en vätgasbrännare.


utseendet på en vätgasbrännare, vars bas anses vara en självtillverkad elektrolysator
Att känna till typer, nyckelegenskaper, enhet och arbetsprincip för joninstallationer, kan du utföra korrekt montering av en egengjord konstruktion, vilket är en utmärkt assistent i en rad vardagliga situationer: från svetsning och sparar bränsleförbrukning hos motorfordon till hur värmesystem fungerar.
Anordning och funktionsprincip
Katod och anod
Den enklaste elektrolysanläggningen består av flera "celler", som alla inkluderar:
- 2 plattelektroder - katod (negativ) och anod (positiv);
- En gummipackning runt omkretsen av två intilliggande olika elektroder.
De yttre cellerna är utrustade med speciella rör genom vilka de utvecklade gaserna släpps ut.
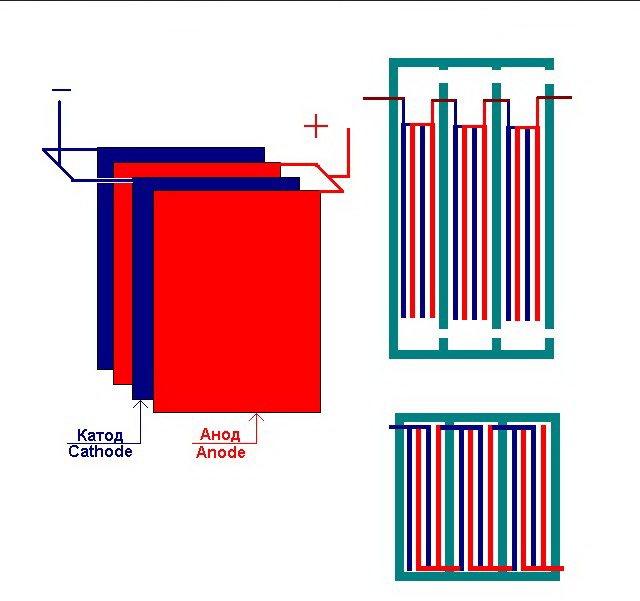

Flera sammankopplade "celler" i elektrolysanläggningen
Elektrolysatorn kan innehålla från 1 till 30-40 eller fler sådana "celler", plattorna med samma namn är seriekopplade.
Viktig! Vid användning av strömförsörjning med växelström används dessutom likriktare, varav det enklaste är en diodbro.
En sådan installation fungerar enligt följande:
- Destillerat vatten med alkali eller vanlig natron löst i det hälls i utrymmet mellan elektroderna;
- En spänning på 1,8-2,0 V matas från strömförsörjningen till elektroderna i alla celler i installationen;
- Som ett resultat av elektrolysprocessen lockas anjoner (positivt laddade joner) av ett ämne löst i vatten till den negativt laddade katoden, varigenom en tunn natriumfilm bildas på den;
- På en positivt laddad anod inträffar förstörelsen av vattenmolekyler, varvid båda bildar 2 väteatomer och 1 syreatom;
- Den frigjorda detonerande gasen genom grenrören kommer in i behållaren avsedd för den.
Intensiteten i elektrolysprocessen beror på spänningen och strömstyrkan - vid låga värden för dessa egenskaper fortsätter processen inte. Om strömkällan levererar en ström med för höga värden på strömspänningskarakteristiken blir lösningen som hälls i elektrolysatorn mycket varm och kokar bort.
Felsökning och testning av enheten
Då är det nödvändigt att bestämma var bultarna berör lådans väggar och på dessa ställen borra två hål. Om det av någon uppenbar anledning visar sig att bultarna inte passar i behållaren, borde de göra det skär och dra åt för att täta med muttrar... Nu måste du borra ut locket och sätt in de gängade kontakterna där från båda sidor. För att säkerställa ogenomtränglighet bör fogen tätas med ett silikonbaserat tätningsmedel.
När du har monterat din egen elektrolysator med dina egna händer bör du testa den. För att göra detta, anslut enheten till en strömkälla, fyll den med vatten till bultarnasätt på locket genom att ansluta ett rör till kopplingen och sänka den motsatta änden av röret i vattnet. Om strömmen är svag kommer strömmen att vara synlig inifrån elektrolysatorn.
Öka gradvis strömmen i din hemlagade apparat. Destillerat vatten leder inte el bra eftersom det inte innehåller salter eller föroreningar. För att förbereda elektrolyten är det nödvändigt att tillsätta alkali i vattnet. För att göra detta måste du ta natriumhydroxid (finns i medel för rengöring av rör som "Mole"). En säkerhetsventil behövs för att förhindra att en anständig mängd gas ackumuleras.
- Det är bättre att använda destillerat vatten och läsk som katalysator.
- Du bör blanda lite bakpulver med fyrtio delar vatten. Väggarna på sidorna är bäst gjorda av akrylglas.
- Elektroderna är bäst gjorda av rostfritt stål. Det är vettigt att använda guld för tallrikar.
- Använd genomskinlig PVC för underlag. De kan vara 200 x 160 millimeter stora.
- Du kan använda din egen elektrolys, tillverkad av dig själv, för att laga mat, för fullständig förbränning av bensin i bilar och i de flesta fall.
Torra elektrolysatorer används främst för maskiner. Generatorn ökar effekten av förbränningsmotorn. Väte antänds mycket snabbare än flytande bränsle, vilket ökar kolvens kraft. Förutom Mole kan du ta Mister Muscle, kaustisk läsk, bakpulver.
Generatorn fungerar inte på dricksvatten. Det är bättre att ansluta elektricitet så här: den första och den sista plattan - minus, och på plattan i mitten - plus. Ju större plattan är och ju starkare ström, desto mer gas släpps ut.
Typer av elektrolysatorer
DIY punktsvetsning för batterier
Beroende på utformning och driftsprincip finns det 5 typer av elektrolysanläggningar.
Torr
Dessa elektrolysatorer består av plattliknande elektroder åtskilda av förseglade gummipackningar. Ofta placeras installationens "celler" dessutom i ett förseglat hölje.
Vätgas och syre som genereras som ett resultat av elektrolys avlägsnas genom speciella grenrör som ligger i slutet av kroppen eller de extrema plattorna i installationen.
Strömmande
Elektrolysinstallationer av denna typ har följande anordning:
- Ett elektrolysbad (kropp) med två munstycken, genom vilka en matas elektrolyt in i det, genom det andra utmatas den detonerande gas som bildas som ett resultat av elektrolys;
- Plattelektroder åtskilda av distanser;
- En tank med elektrolyt placerad ovanför huset med elektroder och förbundna med slangar till grenrören i installationens elektrolysbad och med ett grenrör med en gasventil i den övre delen.
Under drift av en sådan anordning kommer den utvecklade gasen genom grenröret och slangen in i tanken med elektrolyten och, vilket skapar ett visst tryck i den, lämnar installationen genom ventilen på grenröret.
Membran
Elektrolyscellerna i sådana installationer består av två elektroder åtskilda av ett tunt membran som gör att elektrolysprodukter kan passera och separerar elektroderna från varandra.
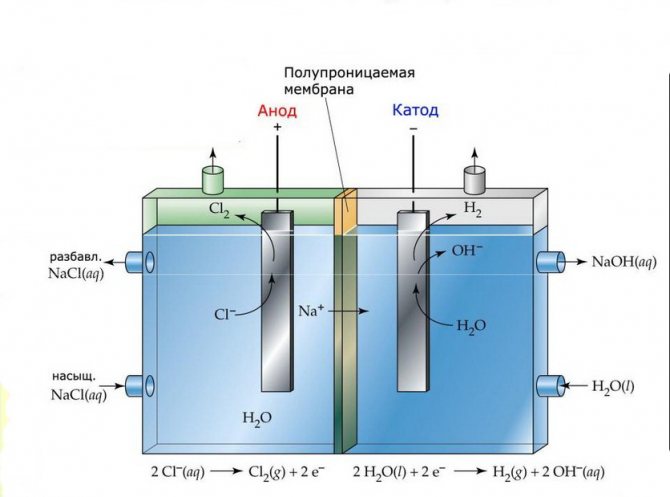

Membranelektrolysanläggning
Diafragman
Elektrolysinstallationer av denna typ består av en "U" -formad kolv med två elektroder införda i den och 2-3 ogenomträngliga membran. Liknande elektrolysatorer används för separat produktion av rent väte och syre.
Alkalisk
Till skillnad från andra modeller av elektrolysatorer används i dessa en alkalilösning som en elektrolyt - kaustisk soda (natriumhydroxid), som inte bara är en ytterligare källa för väte och syre utan också en katalysator för elektrolys.
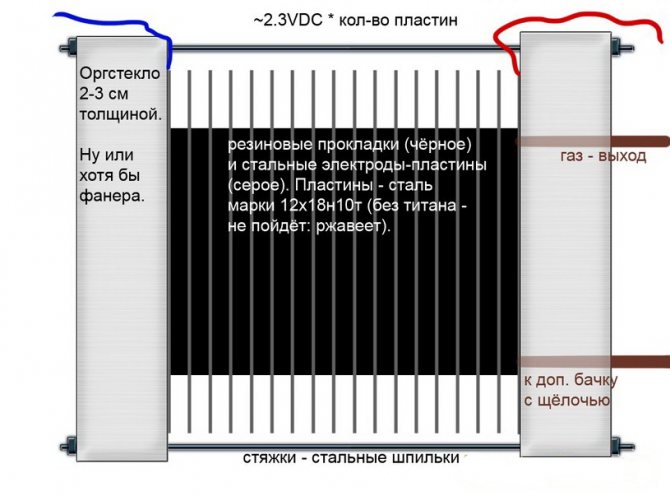

Alkalisk elektrolyskrets
Sådana installationer, till skillnad från analoger av andra typer, tillåter användning av billigare elektroder gjorda av vanligt järn.
Gör elektrolysern med egna händer
Visst känner du till elektrolysprocessen från grundskolans läroplan. Detta är när två polära elektroder placeras i vatten under ström för att erhålla metaller eller icke-metaller i sin rena form. En elektrolysator behövs för att sönderdela vattenmolekyler i syre och väte. Elektrolysern delar, som en del av vetenskapliga mekanismer, molekyler i joner.
Det finns två typer av denna enhet:
- Torr elektrolysator (detta är en helt sluten cell);
- Våt elektrolysator (dessa är två metallplattor placerade i en behållare med vatten).
Enheten är enkel när det gäller enheten, vilket gör det möjligt använd även hemma... Elektrolysatorer delar upp elektrolysladdningarna av molekylernas atomer i laddade atomer.
I vårt fall delar den vatten i positivt väte och negativt syre. För att göra detta krävs en stor mängd energi och för att göra mindre av den erfordrade mängden energi används en katalysator.
Elektrolysator för väteproduktion
Jordning beräkning
För att montera den enklaste elektrolysatorn med egna händer kan du använda ritningen som visas i figuren.
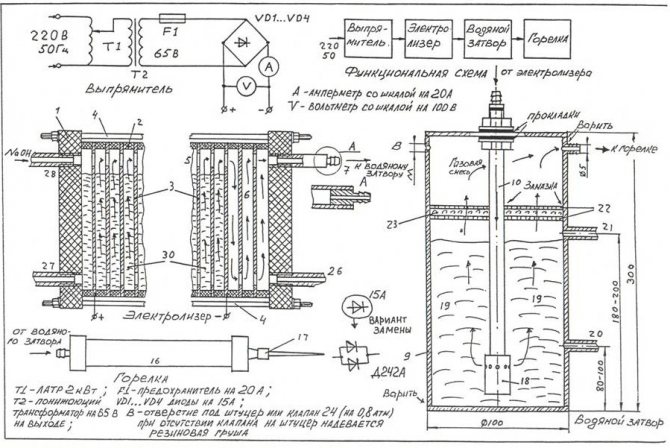

Ritning av den enklaste hemlagade elektrolysatorn
Notera! En elektrolysator är en ganska farlig installation, som under drift kan oxivätegas, som ackumuleras i stora mängder, orsaka en allvarlig explosion. Enheten ska inte placeras nära källor till öppen eld, värmeenheter.
DIY elektrolyserare för en bil
För att förbättra förbränningen av bränsle i en bilmotor monteras ofta en elektrolysator, bestående av ett hölje från ett gammalt batteri med rostfria stålplattor placerade inuti, två munstycken, varav en är ansluten till en tank fylld med elektrolyt, den andra är ansluten till en lufttillförselslang till motorn (närmare bestämt med en korrugerad från luftintaget till luftfiltret).
En sådan hemmagjord flytande elektrolysator drivs från bilens batteri med hjälp av ett relä och en 10 A säkring.
Vi skapar en enhet med egna händer
Enheten för denna process kan göras för hand.
För detta behöver du:
- Rostfritt stålplåt;
- Bultar M6 x 150;
- Brickor;
- Nötter;
- Transparent rör;
- Anslutande element med tråd på båda sidor;
- En och en halv liter plastbehållare;
- Vattenfilter;
- Kontrollera ventilen för vatten.
Ett utmärkt alternativ för rostfritt stål är AISI 316L från en utländsk tillverkare eller 03X16H15M3 från en tillverkare från vårt land. Det finns absolut inget behov av att köpa rostfritt stål, du kan ta det gamla. 50 till 50 centimeter räcker för dig.
"Varför ta rostfritt stål själv?" - du frågar. Eftersom den vanligaste metallen kommer att korrodera. Rostfritt stål tål alkalier bättre. Skall skissera arket på ett sådant sätt att det delas upp i 16 liknande rutor... Du kan klippa den med en vinkelslip. Klipp ett av hörnen i varje kvadrat.
På andra sidan och mittemot hörn, från det avsågade hörnet, borra ett hål för en bult som hjälper till att hålla plattorna ihop. Elektrolysatorn slutar inte fungera så här:t plattelektricitet strömmar till plattan - och vatten sönderdelas i syre och väte. Tack vare detta behöver vi en bra och negativ platta.
Plattorna måste anslutas växelvis: plus-minus-plus-minus, med en liknande metod kommer det att finnas en stark ström. För att isolera plattorna en från en används ett rör. En ring skärs från nivån. Genom att klippa den blir vi en millimeter tjock. Detta avstånd är mer korrekt för framställning av gas.
Plattorna är sammankopplade med brickor: vi sätter en bricka på bulten, sedan en tallrik och tre brickor, sedan en tallrik igen och så vidare. På plus och minus måste åtta tallrikar planteras. Om allt görs korrekt kommer inte skärningarna på plattorna att beröra elektroderna.
Då måste du dra åt muttrarna och isolera plattorna. Sedan placerar vi strukturen i en plastbehållare.
Översikt över tillverkare av elektrolysatorer
De viktigaste tillverkarna av elektrolysörer är båda inhemska företag (RUSAL, NPF RutTech, JSC Uralkhimmash), liksom deras utländska konkurrenter - Teledyne Energy Systems, Inc (USA), Hydrogenics Corp. (Belgien).
Således är elektrolysatorn en ganska enkel och funktionsrik installation som används för att producera oxivätegas, som i framtiden är planerad att användas som bränsle för förbränningsmotorer och värmepannor.
Gör-det-själv-hem-elektrolys
När jag var liten ville jag alltid göra något själv, med egna händer. Men föräldrarna (och andra nära människor) tillät i de flesta fall inte detta. Och jag såg inte då (och hittills ser jag inte) något dåligt när små barn vill lära sig ??
Naturligtvis skrev jag inte den här artikeln för att komma ihåg barndomsupplevelser i önskan att starta självutbildning. Bara av en slump, när jag surfa på internet, stötte jag på en fråga av det här slaget. Någon liten bomberpojke ställde frågor om hur man gör elektrolys hemma. Det är sant att jag inte svarade honom, för den här pojken ville elektrolysera den smärtsamt misstänkta blandningen ?? Jag bestämde mig för att jag inte skulle säga längre bort från synd, låt mig själv titta i böcker. Men för inte så länge sedan, igen som jag vandrade genom forumen, såg jag en liknande fråga från en lärare vid en kemiskola. Att döma av beskrivningen är hans skola så dålig att den inte kan (vill inte) köpa en elektrolysator för 300 rubel. Läraren (vilket problem!) Kunde inte hitta en väg ut ur den resulterande situationen. Så jag hjälpte honom. För de som är nyfikna på denna typ av hemlagade produkter lägger jag upp den här artikeln på webbplatsen.
Egentligen är produktionsprocessen och användningen av vår egenpall mycket primitiv. Men jag kommer att berätta om säkerhet först och om tillverkning - i det andra. Och poängen är att vi pratar om en demonstrationselektrolysator och inte om en industrianläggning. Tack vare detta kommer det för säkerhet att vara bra att driva det inte från nätverket utan från AA-batterier eller från ett batteri. Ju högre spänning desto snabbare kommer elektrolysprocessen att gå. Men för visuell observation av gasbubblor är det ganska tillräckligt med 6 V., men 220 är redan överdrivet. med en sådan spänning kokar till exempel vatten snabbast, och det här är inte särskilt säkert ... Tja, jag tror att du tänkte på spänningen?
Låt oss nu prata om var och under vilka förhållanden vi kommer att experimentera. Det allra första, det borde vara antingen ledigt utrymme eller ett välventilerat rum. Även om jag gjorde allt i en lägenhet med stängda fönster och inget liknande? För det andra görs experimentet bäst på ett bra bord. Ordet "bra" betyder att bordet måste vara stabilt och bättre tungt, styvt och fäst vid golvytan. I detta fall måste bordsskyddet vara beständigt mot aggressiva ämnen. Förresten, kakel från en kakel är perfekt för detta (men inte alla, tyvärr). Ett sådant bord kommer att vara till nytta inte bara för den här upplevelsen. Men jag gjorde allt på en vanlig pall ?? För det tredje behöver du inte flytta strömkällan (i mitt fall batterier) under experimentet. Tack vare detta, för tillförlitlighet, är det bäst att omedelbart lägga dem på bordet och fixa dem så att de inte springer ut. Tro mig, det här är bekvämare än att hålla dem regelbundet med händerna. Jag band helt enkelt mina egna batterier med tejp till det första hårda föremålet jag såg. För det fjärde, de rätter som vi kommer att experimentera med, låt dem vara små. Ett enkelt glas passar eller ett skottglas. Förresten, detta är det mest optimala sättet att använda glas hemma, i motsats till att hälla alkohol i dem med ytterligare användning ...
Låt oss nu gå vidare specifikt till enheten. Det finns i figuren, men för närvarande kommer jag kort att förklara vad och vad.
Vi måste ta en enkel penna och ta bort trädet från den med en vanlig kniv och få en hel ledning ur pennan. Du kan dock ta en ledning från en mekanisk penna. Men det finns två svårigheter samtidigt. Den första är den vanliga. Ledningen från en mekanisk penna är för tunn, för oss är detta helt enkelt inte lämpligt för ett visuellt experiment. Den andra svårigheten är någon oförståelig sammansättning av de nuvarande skifferna. Det känns som om de inte är gjorda av grafit utan från något annat. I allmänhet lyckades min erfarenhet av en sådan "bly" inte alls, inte ens med en spänning på 24 V. Tack vare detta behövde jag välja en bra träig enkel penna. Den resulterande grafitstången kommer att fungera som en elektrod för oss. Som du kan föreställa dig behöver vi två elektroder. Tack vare detta väljer vi den andra pennan eller helt enkelt bryter den befintliga staven i två. Jag gjorde faktiskt det här.
Med vilken tråd som helst som kommer till hands, slår vi in den första ledningselektroden (med ena änden av ledningen) och vi ansluter den här ledningen till minus av strömkällan (med den andra änden). Sedan tar vi andra ledningen och gör samma sak med den. För detta, baserat på detta, behöver vi en andra tråd. Men i det här fallet ansluter vi den här ledningen till strömförsörjningens plus. Om du har problem med att fästa den ömtåliga grafitstaven på tråden kan du använda verktygen till hands, till exempel tejp eller tejp. Om det inte gick att klistra in spetsen på grafiten med själva tråden och tejpen eller isoleringstejpen inte gav någon tät kontakt, försök sedan limma ledningen med ledande lim. Om du inte har det här, binda åtminstone ledningen till tråden med en tråd. Ingen anledning att vara rädd, tråden kommer inte att brinna ut från en sådan spänning ??
För de som inte vet någonting om batterier och de enkla reglerna för anslutning av dem, kommer jag att förklara lite. Fingerbatteriet producerar en spänning på 1,5 V. På bilden har jag två liknande batterier. Dessutom är de anslutna gradvis - en efter en, inte parallellt. Med en liknande (seriell) anslutning kommer den slutliga spänningen att summeras från spänningen i varje batteri, det vill säga för mig är det 1,5 + 1,5 = 3,0 V. Detta är mindre än de tidigare angivna 6 volt. Men jag var för lat för att köpa några fler batterier. Princip du och så måste vara tydlig ??
Låt oss börja experimentet. Till exempel kommer vi att begränsa oss till elektrolys av vatten.För det första är det mycket tillgängligt (jag hoppas att läsaren av den här artikeln inte bor i Sahara), och för det andra är den ofarlig. Dessutom kommer jag att visa hur med samma enhet (elektrolysator) med samma ämne (vatten) för att utföra två olika erfarenhet. Jag tror att du har tillräckligt med fantasi för att komma med ett gäng liknande experiment med andra ämnen ?? I allmänhet är kranvatten lämpligt för oss. Men jag rekommenderar att du lägger till lite mer av det och saltar det. Lite grann - det betyder en liten nypa, inte en hel dessertsked. Det här är viktigt! Rör om saltet väl för att lösa upp det. Så vatten, som är ett dielektrikum i rent tillstånd, leder perfekt elektricitet. i början av experimentet, torka av bordet från potentiell fukt och lägg sedan på strömkällan och ett glas vatten på det.
Vi sänker båda elektroderna, närvarande under spänning, i vattnet. Se till att endast grafit är nedsänkt i vattnet och att själva kabeln inte får röra vid vattnet. Början på experimentet kan försenas. Tiden beror på många indikatorer: på vattnets sammansättning, ledarnas kvalitet, grafitens kvalitet och naturligtvis strömkällans spänning. Början på min reaktion försenades i några sekunder. Syre börjar utvecklas på elektroden som var ansluten till plus av batterierna. Väte släpps ut på elektroden ansluten till minus. Det bör noteras att det finns fler vätebubblor. Mycket små bubblor sticker runt den del av grafiten som är nedsänkt i vattnet. Sedan börjar några av bubblorna flyta.
Elektrod i början av experimentet. Det finns inga gasbubblor än. Vätebubblor bildas på elektroden ansluten till batteriets minuspol
Vilka andra experiment kan det finnas? Om du redan har spelat tillräckligt med väte och syre fortsätter vi till ett nytt experiment. Det är mer intressant, särskilt för hemforskare. Det är intressant genom att det är möjligt att inte bara se det utan också att lukta det. Tidigare erfarenhet fick vi syre och väte, som enligt min mening inte är särskilt spektakulära. Och i ett annat experiment får vi två ämnen (förresten användbara i vardagen). i början av experimentet, stoppa föregående experiment och torka elektroderna. Ta nu bordssalt (som du brukar använda i köksrummet) och lös det i vattenmassan. I det här fallet inte en liten mängd. Egentligen är en anständig mängd salt det enda som gör den andra upplevelsen annorlunda än den första. Efter att saltet har lösts upp kan du omedelbart upprepa experimentet. Nu sker en annan reaktion. På en bra elektrod är det inte syre som släpps ut nu, utan klor. Och negativt släpps också väte. När det gäller glaset i vilket saltlösningen är belägen finns natriumhydroxid kvar i den efter långvarig elektrolys. Detta är den välbekanta kaustiska soda, alkali.
Klor, du kommer att kunna lukta det. Men för bästa resultat rekommenderar jag att du tar en spänning på minst 12 V. Annars kanske du inte känner aromen. Förekomsten av alkali (efter en mycket lång elektrolys) i glaset kan kontrolleras på flera sätt. Det enklaste och mest våldsamma är att lägga handen i glaset. En etnisk varning säger att om en brännande känsla börjar finns det alkali i glaset. Ett smartare och tydligare sätt är lakmustestet. Om din skola är så dålig att den inte ens kan skaffa sig en lakmus hjälper indikatorerna till hands dig. En av dessa kan, som de säger, fungera som en droppe betorjuice ?? Men det är fullt möjligt att bara droppa lite fett i lösningen. Såvitt jag vet borde förtvålning äga rum.
För de mycket nyfikna kommer jag att beskriva vad som faktiskt hände under experimenten. I det första experimentet, under påverkan av en elektrisk ström, ägde en liknande reaktion rum: 2 H2O >>> 2 H2 + O2 Båda gaserna flyter naturligt från vattnet till ytan. Förresten, flytande gaser kan fångas. Kan du göra det själv?
I ett annat experiment var reaktionen helt annorlunda.Det initierades också av en elektrisk ström men nu fungerade inte bara vatten utan också salt som reagens: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Tänk på att reaktionen måste ske i ett överskott av vatten. För att ta reda på vilken mängd salt som anses vara störst kan du räkna det från ovanstående reaktion. Du kan fortfarande tänka på hur du kan förbättra enheten eller vilka andra experiment som kan göras. Det är faktiskt möjligt att natriumhypoklorit kan erhållas genom elektrolys. Under laboratorieförhållanden erhålls det i de flesta fall genom att leda gasformigt klor genom en natriumhydroxidlösning.