Un dels molts processos fisicoquímics que han tingut una àmplia aplicació, tant a la indústria com a la vida quotidiana, és l'electròlisi: la selecció sobre les superfícies dels elèctrodes connectats a una font de corrent col·locada en una solució o fosa, els seus components (metall pur - alumini, coure, gas, etc.). La instal·lació principal dins la qual té lloc aquest procés és un electrolitzador.

Electrolitzador
Què és un electrolitzador
Un electrolitzador és una instal·lació especial que s’utilitza per separar els seus components d’una solució o fosa.
Les principals característiques de l’electrolitzador són:
- La tensió de funcionament d'un elèctrode oscil·la entre 1,8 i 2,0 V;
- Intensitat del corrent: per al curs normal del procés d'electròlisi, es subministra un corrent als elèctrodes amb un valor d'aquesta característica de 5 a 10 A;
- Nombre d'elèctrodes: el nombre mínim d'elèctrodes és 2, el màxim està limitat per la mida de la instal·lació i el seu propòsit;
- Dimensions dels elèctrodes: no s’utilitzen barres de carboni com a elèctrodes, sinó plaques metàl·liques, la mida de les quals està determinada per la finalitat de la instal·lació, la tensió característica del corrent subministrat a les plaques;
- Distància entre les superfícies d'elèctrodes carregades oposadament: la distància mínima entre les plaques d'elèctrodes ha de ser d'almenys 1,5 mm;
- Material d’elèctrodes: en els electrolitzadors moderns s’utilitza xapa d’acer inoxidable amb níquel com a material per a l’ànode i el càtode.
Una altra característica important d'una planta d'electròlisi és l'ús de catalitzadors.
Aquestes instal·lacions s’utilitzen amb els propòsits següents:
- Obtenció d’un gas oxihidrogen, format per una barreja d’hidrogen i oxigen (gas de Brown);
- Aïllament d'alumini pur, magnesi, zinc de la seva sal que es fon;
- Purificació de l'aigua de sals i impureses dissoltes en ella;
- Aplicació d’una fina capa de níquel, zinc que evita la corrosió a la superfície de les peces metàl·liques;
- Desinfecció de productes alimentaris;
- Depuració d’aigües residuals de sals dissoltes de metalls pesants i altres substàncies nocives.
Important! L’elèctrode de platí fabricat amb ferro ordinari s’utilitza amb menys freqüència a les plantes d’electròlisi que a partir d’acer inoxidable, ja que s’oxida més ràpidament i queda inutilitzable.
Electrolitzador de fabricació pròpia
Qualsevol persona pot fabricar un electrolitzador amb les seves pròpies mans. Per al procés de muntatge del disseny més comú, es necessitaran els materials següents:
- xapa d'acer inoxidable (les millors opcions són AISI 316L estrangeres o les nostres 03X16H15M3);
- parabolts М6х150;
- rentadores i fruits secs;
- tub transparent: podeu utilitzar un nivell d'aigua que s'utilitza per a la construcció;
- diversos accessoris d'espiga amb un diàmetre exterior de 8 mm;
- recipient de plàstic amb un volum d’1,5 litres;
- un petit filtre que filtra l'aigua de l'aixeta, per exemple, un filtre per a rentadores;
- vàlvula d’aigua sense retorn
Procés de muntatge
Recolliu l'electrolitzador amb les vostres mans segons les instruccions següents:
- En primer lloc, cal marcar i la posterior serrada de la xapa d’acer inoxidable en quadrats idèntics. La serrada es pot fer amb un molinet angular (molinet angular). Una de les cantonades d’aquestes caselles s’ha de tallar en un angle per assegurar correctament les plaques;
- A continuació, heu de fer un forat per al cargol al costat de la placa oposada a la serra de cantonada tallada;
- La connexió de les plaques s'ha de fer al seu torn: una placa a "+", la següent a "-" i així successivament;
- Entre les plaques de càrrega diferent hi hauria d’haver un aïllant, que actuï com a tub des del nivell espiritual.S'ha de tallar en anelles, que s'han de tallar longitudinalment per obtenir tires d'un gruix d'1 mm. Aquesta distància entre les plaques és suficient per a una bona evolució del gas durant l'electròlisi;
- Les plaques es fixen juntes mitjançant arandeles de la següent manera: es posa una rentadora al cargol, després una placa, després tres arandeles, després d’una placa, etc. Les plaques, carregades favorablement, es col·loquen en una imatge mirall de fulls carregats negativament. Això permet evitar que les vores serrades toquin els elèctrodes;


Les plaques de la planta d’electròlisi s’uneixen
- En muntar les plaques, les heu d’aïllar simultàniament i estrènyer les femelles;
- A més, cal anellar cada placa per assegurar-se que no hi ha curtcircuit;
- A més, tot el conjunt s’ha de col·locar en una caixa de plàstic;
- Després d'això, val la pena destacar els llocs on els parabolts toquen les parets del contenidor, on es realitzen dos forats. Si els cargols no s’adapten al contenidor, cal tallar-los amb una serra per a metalls;
- A continuació, els cargols s’estrenyen amb femelles i arandeles per a la hermeticitat de l’estructura;


Plats col·locats en un recipient de plàstic
- Després dels passos realitzats, haureu de fer forats a la tapa del contenidor i inserir-hi els accessoris. La impermeabilitat en aquest cas es pot assegurar segellant les juntes amb segelladors a base de silicona;
- Una vàlvula de seguretat i un filtre a l'estructura es troben a la sortida del gas i serveixen com a mitjà per controlar una acumulació excessiva de gas que pot conduir a mals resultats;
- La unitat d’electròlisi està muntada.
L'última etapa és una prova, que es realitza de manera similar:
- omplir el recipient d’aigua fins a la marca dels cargols de fixació;
- connexió d'alimentació al dispositiu;
- connexió a l’acoblament del tub, l’extrem oposat del qual es baixa a l’aigua.
Si s’aplica un corrent feble a la instal·lació, l’alliberament de gas a través del tub serà gairebé imperceptible, però es podrà veure des de l’interior de l’electrolitzador. En augmentar el corrent altern, afegint un catalitzador alcalí a l’aigua, es pot augmentar significativament el rendiment de gas.
L’electrolitzador fabricat, per regla general, és una part important de molts dispositius, per exemple, un cremador d’hidrogen.


l’aparició d’un cremador d’hidrogen, la base del qual es considera un electrolitzador de fabricació pròpia
Coneixent els tipus, les característiques clau, el dispositiu i el principi de funcionament de les instal·lacions iòniques, podeu realitzar el muntatge correcte d’una estructura de fabricació pròpia, que és un excel·lent assistent en diverses situacions quotidianes: des de soldar i estalviar el consum de combustible dels vehicles de motor fins el funcionament dels sistemes de calefacció.
Dispositiu i principi de funcionament
Càtode i ànode
La planta d'electròlisi més simple consta de diverses "cèl·lules", cadascuna de les quals inclou:
- 2 elèctrodes de placa: càtode (negatiu) i ànode (positiu);
- Una junta de goma al voltant del perímetre de dos elèctrodes diferents adjacents.
Les cèl·lules exteriors estan equipades amb canonades especials a través de les quals es descarreguen els gasos evolucionats.
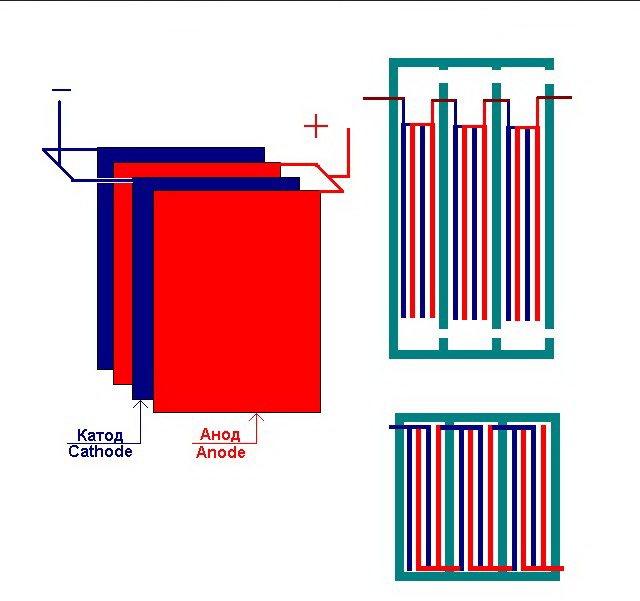

Diverses "cèl·lules" interconnectades de la planta d'electròlisi
L'electrolitzador pot contenir entre 1 i 30-40 o més "cèl·lules" d'aquest tipus, les plaques del mateix nom estan connectades en sèrie.
Important! Quan s’utilitzen fonts d’alimentació amb corrent altern, també s’utilitzen rectificadors, el més senzill dels quals és un pont de díodes.
Aquesta instal·lació funciona de la següent manera:
- L’aigua destil·lada amb alcalí dissolt o bicarbonat de sodi normal s’aboca a l’espai entre els elèctrodes;
- Es subministra un voltatge d’1,8-2,0 V des de la font d’alimentació als elèctrodes de totes les cel·les de la instal·lació;
- Com a resultat del procés d’electròlisi, els anions (ions carregats positivament) d’una substància dissolta a l’aigua són atrets pel càtode carregat negativament, com a resultat del qual es forma una fina pel·lícula de sodi sobre ell;
- En un ànode carregat positivament, es produeix la destrucció de les molècules d'aigua, amb cadascuna formada 2 àtoms d'hidrogen i 1 àtom d'oxigen;
- El gas detonant alliberat a través de les canonades de derivació entra al contenidor destinat a això.
La intensitat del procés d’electròlisi depèn de la tensió i la intensitat del corrent; a valors baixos d’aquestes característiques, el procés no continuarà. Si la font d'alimentació subministra un corrent amb valors massa alts de la característica de corrent-voltatge, la solució abocada a l'electrolitzador estarà molt calenta i bullirà.
Depuració i proves del dispositiu
A continuació, cal determinar on toquen els parabolts a les parets de la caixa i, en aquests llocs, practicar dos forats. Si per cap motiu aparent resulta que els cargols no caben al contenidor, haurien de fer-ho tallar i apretar per apretar amb femelles... Ara heu de treure la tapa i inserir-hi els connectors roscats des dels dos costats. Per garantir la impermeabilitat, l’articulació s’ha de segellar amb un segellant a base de silicona.
Després de muntar el vostre propi electrolitzador amb les vostres mans, hauríeu de provar-lo. Per fer-ho, connecteu el dispositiu a una font d’energia, ompliu-lo amb aigua fins als parabolts, col·loqueu la tapa connectant un tub a l'accessori i baixant l'extrem oposat del tub a l'aigua. Si el corrent és feble, el corrent serà visible des de l'interior de l'electrolitzador.
Augmenteu gradualment el corrent del vostre electrodomèstic casolà. L’aigua destil·lada no condueix bé l’electricitat perquè no conté sals ni impureses. Per preparar l’electròlit, cal afegir alcalins a l’aigua. Per fer-ho, cal prendre hidròxid de sodi (contingut en mitjans per netejar canonades com "Mole"). Cal una vàlvula de seguretat per evitar que s’acumuli una bona quantitat de gas.
- És millor utilitzar aigua destil·lada i sosa com a catalitzador.
- Heu de barrejar una mica de bicarbonat de sodi amb quaranta parts d’aigua. Les parets dels laterals són de vidre acrílic.
- Els elèctrodes es fabriquen millor en acer inoxidable. Té sentit fer servir or per a plaques.
- Utilitzeu PVC translúcid per al suport. Poden tenir una mida de 200 per 160 mil·límetres.
- Podeu utilitzar el vostre propi electrolitzador, fabricat per vosaltres mateixos, per cuinar aliments, per a la combustió completa de la gasolina als cotxes i en la majoria dels casos.
Els electrolitzadors secs s’utilitzen principalment per a màquines. El generador augmenta la potència del motor de combustió. L’hidrogen s’encén molt més ràpid que el combustible líquid, augmentant la força del pistó. A més de Mole, podeu prendre Mister Muscle, sosa càustica, bicarbonat de sodi.
El generador no funciona amb aigua potable. És millor connectar l’electricitat així: la primera i l’última placa –menys i a la placa del centre–, més. Com més gran sigui l’àrea de les plaques i més intens sigui el corrent, més gas s’allibera.
Tipus d’electrolitzadors
Soldadura puntual de bricolatge per a bateries
Segons el disseny i el principi de funcionament, hi ha 5 tipus de plantes d’electròlisi.
Sec
Aquests electrolitzadors consisteixen en elèctrodes de plaques separats per juntes de goma segellades. Sovint, les "cel·les" de la instal·lació es col·loquen addicionalment en un recinte tancat.
L’hidrogen i l’oxigen generats com a resultat de l’electròlisi s’eliminen a través de canonades especials situades a l’extrem del cos o a les plaques extremes de la instal·lació.
Que flueix
Les instal·lacions d’electròlisi d’aquest tipus tenen el dispositiu següent:
- Un bany d’electròlisi (cos) amb dos brocs, a través d’un dels quals s’hi introdueix electròlit, a través del segon es descarrega el gas detonant format com a resultat de l’electròlisi;
- Elèctrodes de plaques separats per separadors;
- Un dipòsit amb electròlit situat sobre la carcassa amb elèctrodes i connectat per mànegues a les canonades de derivació del bany d’electròlisi de la instal·lació i que té un tub de derivació amb una vàlvula de gas a la part superior.
Durant el funcionament d’aquest dispositiu, el gas evolucionat a través de la canonada de derivació i la mànega entren al dipòsit amb l’electròlit i, creant-hi una certa pressió, deixa la instal·lació per la vàlvula del tub de derivació.
Membrana
Les cèl·lules d’electròlisi d’aquestes instal·lacions consisteixen en dos elèctrodes separats per una fina membrana que permet passar productes d’electròlisi i separa els elèctrodes els uns dels altres.
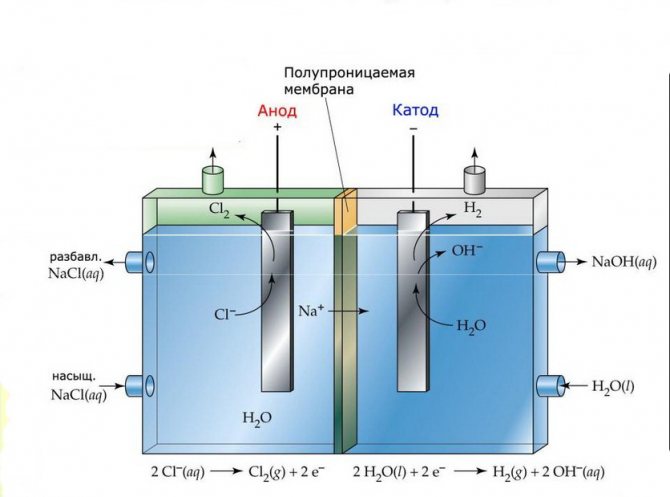

Planta d’electròlisi de membranes
Diafragma
Les instal·lacions d'electròlisi d'aquest tipus consisteixen en un matràs en forma de "U" amb dos elèctrodes inserits i 2-3 diafragmes impermeables. S’utilitzen electrolitzadors similars per a la producció separada d’hidrogen i oxigen pur.
Alcalina
A diferència d'altres models d'electrolitzadors, en aquests, una solució alcalina s'utilitza com a electròlit: sosa càustica (hidròxid de sodi), que no només és una font addicional d'hidrogen i oxigen, sinó també un catalitzador per a l'electròlisi.
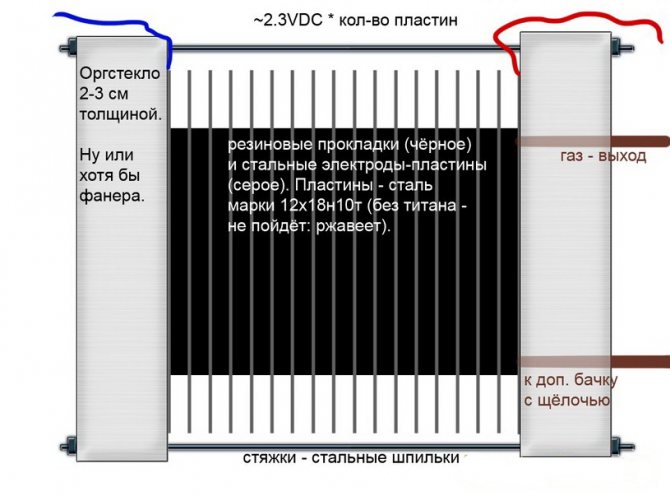

Circuit electrolitzador alcalí
Aquestes instal·lacions, a diferència d’altres anàlegs, permeten l’ús d’elèctrodes més econòmics de ferro normal.
Feu l'electrolitzador amb les vostres mans
Segur que coneixeu el procés d’electròlisi del currículum de l’escola primària. És quan dos elèctrodes polars es col·loquen a l’aigua sota corrent per obtenir metalls o no metalls en estat pur. Es necessita un electrolitzador per descompondre les molècules d’aigua en oxigen i hidrogen. L’electrolitzador, com a part dels mecanismes científics, divideix les molècules en ions.
Hi ha dos tipus d’aquest dispositiu:
- Electrolitzador sec (es tracta d’una cel·la completament tancada);
- Electrolitzador humit (són dues plaques metàl·liques col·locades en un recipient amb aigua).
Aquest dispositiu és senzill pel que fa al dispositiu, cosa que ho fa possible utilitzar fins i tot a casa... Els electrolitzadors divideixen les càrregues d’electròlisi dels àtoms de les molècules en àtoms carregats.
En el nostre cas, divideix l’aigua en hidrogen positiu i oxigen negatiu. Per fer-ho, es necessita una gran quantitat d’energia i, per fer menys de la quantitat d’energia necessària, s’utilitza un catalitzador.
Electrolitzador per a la producció d’hidrogen
Càlcul de connexions a terra
Per muntar l'electrolitzador més senzill amb les vostres mans, podeu utilitzar el dibuix que es mostra a la figura.
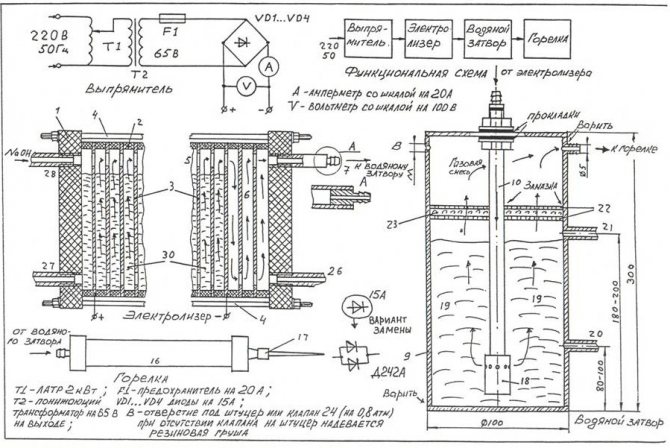

Dibuix de l'electrolitzador casolà més senzill
Nota! Un electrolitzador és una instal·lació força perillosa que, durant el funcionament, el gas oxihidrogen, que s’acumula en grans quantitats, pot provocar una greu explosió. La unitat no s’ha de col·locar a prop de dispositius de calefacció de foc obert.
Electrolitzador de bricolatge per a un cotxe
Per millorar la combustió del combustible en un motor de cotxe, sovint es munta un electrolitzador, que consisteix en una caixa d’una antiga bateria amb plaques d’acer inoxidable col·locades a l’interior, dos brocs, un dels quals està connectat a un dipòsit ple d’electròlit, el segon és connectat a una mànega de subministrament d’aire al motor (més precisament, amb un corrugat des de la presa d’aire fins al filtre d’aire).
Un electrolitzador casolà que s’alimenta de la bateria del cotxe mitjançant un relé i un fusible de 10 A.
Creem un dispositiu amb les nostres pròpies mans
El dispositiu per a aquest procés es pot fer a mà.
Per a això, necessitareu:
- Xapa d'acer inoxidable;
- Perns M6 x 150;
- Rentadores;
- Fruits secs;
- Tub transparent;
- Elements de connexió amb rosca a banda i banda;
- Un envàs de plàstic d’un litre i mig;
- Filtre d'aigua;
- Vàlvula de retenció d’aigua.
Una opció excel·lent per a l’acer inoxidable és AISI 316L d’un fabricant estranger o 03X16H15M3 d’un fabricant del nostre país. No hi ha absolutament cap necessitat de comprar acer inoxidable, podeu agafar l’antic. De 50 a 50 centímetres n’hi ha prou.
"Per què prendre l'acer inoxidable?" - demanes. Ja que el metall més comú es corroirà. L’acer inoxidable tolera millor els àlcalis. Hauria esbossem el full de manera que el dividim en 16 quadrats semblants... Podeu tallar-lo amb una amoladora angular. A cada quadrat, talla una de les cantonades.
A l’altre costat i cantó oposat, des de la cantonada serrada, practiqueu un forat per a un pern que ajudarà a mantenir les plaques juntes. L'electrolitzador no para de funcionar així:La electricitat de la placa t flueix cap a la placa - i l’aigua es descompon en oxigen i hidrogen. Gràcies a això, necessitem un plat bo i negatiu.
Les plaques s'han de connectar alternativament: més-menys-més-menys, amb un mètode similar, hi haurà un fort corrent. Per aïllar les plaques una d’una, s’utilitza un tub. Es talla un anell des del nivell. Tallant-lo, obtenim una tira de mil·límetre de gruix. Aquesta distància és més correcta per fabricar gas.
Les plaques estan interconnectades amb volanderes: posem una volandera al cargol, després una placa i tres volanderes, després un plat de nou, etc. Al plus i al menys, s’han de plantar vuit plaques. Si tot es fa correctament, els talls de les plaques no tocaran els elèctrodes.
Després cal apretar les femelles i aïllar les plaques. A continuació, posem l’estructura en un recipient de plàstic.
Visió general dels fabricants d’electrolitzadors
Els principals productors d’electrolitzadors són empreses nacionals (RUSAL, NPF RutTech, JSC Uralkhimmash), així com els seus competidors estrangers: Teledyne Energy Systems, Inc (EUA), Hydrogenics Corp. (Bèlgica).
Per tant, l’electrolitzador és una instal·lació bastant senzilla i rica en funcions que s’utilitza per produir gas oxigenat, que en el futur es preveu utilitzar com a combustible per a motors de combustió interna i calderes de calefacció.
Feu-vos-ho mateix electròlisi domèstica
Quan era petit, sempre volia fer alguna cosa jo mateix, amb les meves pròpies mans. Però els pares (i altres persones properes) en la majoria dels casos no ho van permetre. I no vaig veure llavors (i fins ara no veia) res dolent quan els nens petits volen aprendre ??
Per descomptat, no vaig escriure aquest article per tal de recordar les experiències de la infància en el desig d’iniciar l’autoeducació. Per casualitat, quan navegava per Internet, em vaig trobar amb una pregunta d’aquest tipus. Un nen petit bombarder va fer preguntes sobre com fer electròlisi a casa. És cert que no li vaig respondre, perquè aquest noi volia electrolitzar la barreja dolorosament sospitosa ?? Vaig decidir que no diria més enllà del pecat, deixeu-me mirar jo mateix als llibres. Però no fa molt de temps, tornant a passejar pels fòrums, vaig veure una pregunta similar d’un professor d’una escola de química. A jutjar per la descripció, la seva escola és tan pobra que no pot (no vol) comprar un electrolitzador per 300 rubles. El professor (quin problema!) No va poder trobar una sortida a la situació resultant. Així que el vaig ajudar. Per a aquells que tinguin curiositat per aquest tipus de productes casolans, publico aquest article al lloc.
En realitat, el procés de producció i l’ús del nostre autopalet és molt primitiu. Però us parlaré de seguretat primer i de fabricació, a la segona. I la qüestió és que parlem d’un electrolitzador de demostració i no d’una planta industrial. Gràcies a això, per seguretat, serà bo alimentar-lo no des de la xarxa, sinó de piles AA o des d’una bateria. Naturalment, com més alta sigui la tensió, més ràpid serà el procés d’electròlisi. No obstant això, per a l'observació visual de bombolles de gas, és bastant prou 6 V, però el 220 ja és excessiu. amb aquest voltatge, l'aigua, per exemple, bullirà més ràpidament, i això no és molt segur ... Bé, crec que heu descobert la tensió?
Ara parlem d’on i en quines condicions experimentarem. El primer, hauria de ser un espai lliure o una habitació ben ventilada. Tot i que ho vaig fer tot en un apartament amb finestres tancades i res semblant? En segon lloc, l’experiment es fa millor en una bona taula. La paraula "bo" significa que la taula ha de ser estable i millor pesada, rígida i fixada a la superfície del terra. En aquest cas, el recobriment de la taula ha de ser resistent a substàncies agressives. Per cert, les rajoles d’una rajola són perfectes per a això (tot i que no totes, malauradament). Una taula com aquesta serà útil no només per a aquesta experiència. Tot i això, ho vaig fer tot en un tamboret normal ?? En tercer lloc, durant l’experiment, no cal moure la font d’energia (en el meu cas, les bateries). Per això, per a la seva fiabilitat, és millor col·locar-los immediatament sobre la taula i arreglar-los perquè no es moguin. Creieu-me, això és més convenient que agafar-los regularment amb les mans. Simplement vaig lligar les meves pròpies bateries amb cinta elèctrica al primer objecte dur que vaig veure. En quart lloc, els plats en què experimentarem, que siguin petits. S’adapta un simple vidre o un got. Per cert, aquesta és la manera més òptima d’utilitzar gots a casa, en lloc d’abocar-hi alcohol amb un altre ús ...
Bé, ara passem específicament al dispositiu. Es proporciona a la figura, però ara per ara explicaré breument què i què.
Hem d’agafar un llapis senzill i treure’n l’arbre amb un ganivet normal i treure’n tota una ploma. Tanmateix, podeu agafar avantatge a partir d’un llapis mecànic. Però hi ha dues dificultats alhora. El primer és l’habitual. El plom d’un llapis mecànic és massa prim, per a nosaltres simplement no és adequat per a un experiment visual. La segona dificultat és una composició incomprensible de les pissarres actuals. Sembla que no estan fets de grafit, sinó d’una altra cosa. En general, la meva experiència amb aquest "plom" no va tenir cap èxit, fins i tot amb una tensió de 24 V. Gràcies a això, vaig haver de triar un bon llapis llenyós i senzill. La vareta de grafit resultant ens servirà com a elèctrode. Com us podeu imaginar, necessitem dos elèctrodes. Gràcies a això, anem a triar el segon llapis o simplement trenquem la vareta existent en dos. De fet, vaig fer això.
Amb qualsevol cable que ens arribi a la mà, emboliquem el primer elèctrode de plom (amb un extrem del cable) i connectem aquest cable al menys de la font d’energia (amb l’altre extrem). Després agafem el segon avantatge i fem el mateix amb ell. Per a això, basat en això, necessitem un segon cable. Però en aquest cas, connectem aquest cable al plus de la font d'alimentació. Si teniu problemes per fixar la fràgil vareta de grafit al fil, podeu utilitzar les eines disponibles, com ara cinta adhesiva o cinta adhesiva. Si no va funcionar embolicar la punta del grafit amb el propi filferro i la cinta o la cinta aïllant no proporcionaven cap contacte estret, intenteu enganxar el cable amb cola conductora. Si no en teniu, almenys lligueu el fil amb un fil. No cal tenir por, el fil no es cremarà per aquesta tensió ??
Per a aquells que no saben res sobre les bateries i les senzilles regles per connectar-les, us explicaré una mica. La bateria tipus dit dóna un voltatge d’1,5 V. A la imatge tinc dues bateries similars. A més, estan connectats gradualment - un darrere l’altre, no en paral·lel. Amb una connexió similar (en sèrie), la tensió final es resumirà a partir del voltatge de cada bateria, és a dir, per a mi és 1,5 + 1,5 = 3,0 V. Això és inferior als 6 volts indicats anteriorment. Però em feia mandra anar a comprar unes quantes bateries més. Principi tu i per tant ha de quedar clar ??
Comencem l’experiment. Per exemple, ens limitarem a l'electròlisi de l'aigua.En primer lloc, és molt accessible (espero que el lector d’aquest article no visqui al Sàhara) i, en segon lloc, sigui inofensiu. A més, mostraré com fer-ho amb el mateix dispositiu (electrolitzador) amb la mateixa substància (aigua) diversos experiència. Crec que teniu prou imaginació per fer un munt d’experiments similars amb altres substàncies ?? En general, l’aigua de l’aixeta és adequada per a nosaltres. Però us recomano afegir-ne una mica més i salar-lo. Una mica - això significa una mica de pessic, no una cullera de postres sencera. Això és important. Remeneu bé la sal perquè es dissolgui. Així doncs, l’aigua, en ser un dielèctric en estat pur, conduirà perfectament l’electricitat. al principi de l’experiment, netegeu la taula de la humitat potencial i, a continuació, poseu-hi la font d’energia i un got d’aigua.
Baixem els dos elèctrodes, presents sota tensió, a l’aigua. Al mateix temps, assegureu-vos que només el grafit estigui submergit a l'aigua i que el filferro no toqui l'aigua. És possible que el començament de l’experiment es retardi. El temps depèn de molts indicadors: de la composició de l’aigua, la qualitat dels cables, la qualitat del grafit i, per descomptat, la tensió de la font d’energia. El començament de la meva reacció es va retardar un parell de segons. L’oxigen comença a evolucionar a l’elèctrode que estava connectat al plus de les bateries. S’alliberarà hidrogen a l’elèctrode connectat al menys. Cal tenir en compte que hi ha més bombolles d’hidrogen. Al voltant de la part del grafit submergida a l’aigua s’enganxen bombolles molt petites. Aleshores, algunes de les bombolles comencen a surar.
Elèctrode al començament de l’experiment. Encara no hi ha bombolles de gas. Es van formar bombolles d’hidrogen a l’elèctrode connectat al pol negatiu de les bateries
Quins altres experiments hi pot haver? Si ja heu jugat prou amb hidrogen i oxigen, procedim a un altre experiment. És més interessant, sobretot per als investigadors de la llar. És interessant perquè no només es pugui veure, sinó també olorar-lo. En l'experiència passada, vam rebre oxigen i hidrogen, que, al meu entendre, no són gaire espectaculars. I en un altre experiment, obtenim dues substàncies (per cert, útils en la vida quotidiana). al principi de l'experiment, atureu l'experiment anterior i asseceu els elèctrodes. Ara preneu sal de taula (que utilitzeu en la majoria dels casos a la sala de la cuina) i dissoleu-la a la massa d’aigua. En aquest cas, no és una quantitat petita. En realitat, una quantitat decent de sal és l'única cosa que fa que la segona experiència sigui diferent de la primera. Després de dissoldre la sal, podeu repetir immediatament l’experiment. Ara s’està produint una reacció diferent. En un bon elèctrode, ara no s’allibera oxigen, sinó clor. I, en negatiu, també s’allibera hidrogen. Pel que fa al got on es troba la solució salina, l’hidròxid de sodi hi queda després d’una electròlisi prolongada. Es tracta de la sosa càustica familiar, alcalina.
Clor, podreu olorar-lo. Però per obtenir el millor efecte, recomano prendre un voltatge d'almenys 12 V. En cas contrari, és possible que no sentiu l'aroma. La presència d’alcalins (després d’una electròlisi molt llarga) al vidre es pot comprovar de diverses maneres. El més senzill i violent és posar la mà al got. Un presagi ètnic diu que si comença una sensació de cremor, hi ha àlcali al got. Una manera més intel·ligent i diferent és la prova de foc. Si la vostra escola és tan pobra que ni tan sols és capaç d’adquirir el tornasol, els indicadors que teniu a mà us ajudaran. Un d’aquests, com es diu, pot servir com una gota de suc de remolatxa ?? Però és molt possible que degoteu una mica de greix a la solució. Que jo sàpiga, s’hauria de produir la saponificació.
Per als més curiosos, descriuré el que realment va passar durant els experiments. En el primer experiment, sota la influència d’un corrent elèctric, va tenir lloc una reacció similar: 2 H2O >>> 2 H2 + O2 Tots dos gasos suren naturalment de l’aigua a la superfície. Per cert, els gasos flotants poden quedar atrapats. Ho podràs fer tu mateix?
En un altre experiment, la reacció va ser completament diferent.També va ser iniciat per un corrent elèctric, però ara no només l’aigua, sinó també la sal, actuaven com a reactius: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Tingueu en compte que la reacció s’ha de produir en excés d’aigua. Per esbrinar quina quantitat de sal es considera la més gran, podeu comptar-la a partir de la reacció anterior. També podeu pensar com millorar el dispositiu o quins altres experiments es poden fer. De fet, és possible que es pugui obtenir hipoclorit de sodi mitjançant electròlisi. En condicions de laboratori, en la majoria dels casos, s’obté fent passar clor gasós per una solució d’hidròxid de sodi.