Jedan od mnogih fizikalno-kemijskih procesa koji su pronašli široku primjenu, kako u industriji, tako i u svakodnevnom životu, je elektroliza - odabir na površinama elektroda povezanih s izvorom struje smještenim u otopini ili talini, njihovih komponenata (čisti metal - aluminij, bakar, plin itd.). Glavna instalacija unutar koje se odvija ovaj proces je elektrolizator.

Elektrolizator
Što je elektrolizator
Elektrolizator je posebna instalacija koja se koristi za odvajanje njegovih sastojaka od otopine ili taline.
Glavne karakteristike elektrolizatora su:
- Radni napon jedne elektrode kreće se od 1,8 do 2,0 V;
- Snaga struje - za normalan tijek procesa elektrolize na elektrode se dovodi struja s vrijednošću ove karakteristike od 5 do 10 A;
- Broj elektroda - minimalni broj elektroda je 2, maksimum je ograničen veličinom same instalacije i njenom svrhom;
- Dimenzije elektroda - kao elektrode se ne koriste karbonske šipke, već metalne ploče, čija je veličina određena svrhom instalacije, strujno-naponska karakteristika struje koja se dovodi na ploče;
- Udaljenost između nasuprot nabijenih površina elektroda - minimalna udaljenost između ploča elektrode mora biti najmanje 1,5 mm;
- Materijal elektrode - u modernim elektrolizatorima koristi se lim od nehrđajućeg čelika s niklom kao materijal za anodu i katodu.
Također još jedna važna karakteristika postrojenja za elektrolizu je upotreba katalizatora.
Takve instalacije koriste se u sljedeće svrhe:
- Dobivanje plina oksihidrogena, koji se sastoji od smjese vodika i kisika (Brownov plin);
- Izolacija čistog aluminija, magnezija, cinka iz njihovih solnih talina;
- Pročišćavanje vode od soli i nečistoća otopljenih u njoj;
- Primjena tankog sloja nikla, cinka koji sprečava koroziju na površini metalnih dijelova;
- Dezinfekcija prehrambenih proizvoda;
- Pročišćavanje otpadnih voda od otopljenih soli teških metala i drugih štetnih tvari.
Važno! Platinasta elektroda izrađena od običnog željeza koristi se rjeđe u instalacijama za elektrolizu nego od nehrđajućeg čelika, jer brže oksidira i postaje neupotrebljiva.
Vlastiti elektrolizator
Svatko može napraviti elektrolizator vlastitim rukama. Za postupak montaže najčešćeg dizajna bit će potrebni sljedeći materijali:
- lim od nehrđajućeg čelika (najbolje opcije su strani AISI 316L ili naš 03X16H15M3);
- vijci M6h150;
- podloške i matice;
- prozirna cijev - možete koristiti libelu koja se koristi u građevinske svrhe;
- nekoliko okova s riblja kost vanjskog promjera 8 mm;
- plastična posuda zapremine 1,5 litre;
- mali filtar koji filtrira vodu iz slavine, na primjer, filter za perilice rublja;
- nepovratni ventil za vodu.
Postupak montaže
Prikupite elektrolizator vlastitim rukama prema slijedećim uputama:
- Prije svega, trebate označiti i naknadno piljenje lima od nehrđajućeg čelika na identične kvadrate. Piljenje se može izvesti kutnom brusilicom (kutnom brusilicom). Jedan od uglova na takvim kvadratima mora biti odrezan pod kutom kako bi se ploče pravilno učvrstile;
- Dalje, trebate napraviti rupu za vijak na strani ploče nasuprot rezanja kutne pile;
- Spajanje ploča treba vršiti redom: jedna ploča na "+", sljedeća na "-" i tako dalje;
- Između različito nabijenih ploča trebao bi biti izolator, koji djeluje kao cijev od libele.Treba ga rezati na kolutiće, koje treba rezati uzdužno da se dobiju trake debljine 1 mm. Ova udaljenost između ploča dovoljna je za dobar razvoj plina tijekom elektrolize;
- Ploče su međusobno pričvršćene pomoću podložnih pločica na sljedeći način: podloška stoji na svornjaku, zatim ploča, pa tri podloške, nakon ploče i tako dalje. Ploče s povoljnim nabojem postavljaju se u zrcalnu sliku negativno nabijenih listova. To omogućuje sprječavanje dodirivanja piljenih rubova elektroda;


Ploče postrojenja za elektrolizu sastavljene zajedno
- Prilikom sastavljanja ploča, istovremeno biste ih trebali izolirati i zategnuti matice;
- Također, svaka ploča mora biti prstenasta kako bi bili sigurni da nema kratkog spoja;
- Dalje, cjelokupni sklop mora biti smješten u plastičnu kutiju;
- Nakon toga, vrijedi istaknuti mjesta na kojima vijci dodiruju zidove spremnika, gdje bušite dvije rupe. Ako se vijci ne uklapaju u posudu, tada ih treba rezati pilom;
- Zatim se vijci zategnu maticama i podloškama radi nepropusnosti konstrukcije;


Ploče smještene u plastičnu posudu
- Nakon poduzetih koraka, morat ćete napraviti rupe na poklopcu spremnika i umetnuti armaturu u njih. Nepropusnost se u ovom slučaju može osigurati brtvljenjem spojeva brtvilima na bazi silikona;
- Sigurnosni ventil i filter u strukturi nalaze se na izlazu za plin i služe kao sredstvo za kontrolu prekomjerne nakupine plina koja može dovesti do loših rezultata;
- Sastavljena je jedinica za elektrolizu.
Posljednja faza je test koji se izvodi na sličan način:
- punjenje posude vodom do oznake vijaka za pričvršćivače;
- spajanje napajanja na uređaj;
- spoj na priključak cijevi, čiji se suprotni kraj spušta u vodu.
Ako se na instalaciju primijeni slaba struja, tada će ispuštanje plina kroz cijev biti gotovo neprimjetno, ali to će biti moguće promatrati iz unutrašnjosti elektrolizera. Povećavanjem izmjenične struje, dodavanjem alkalnog katalizatora u vodu, prinos plina može se značajno povećati.
Izrađeni elektrolizator u pravilu je važan dio mnogih uređaja, na primjer, vodikov plamenik.


pojava vodikovog plamenika, čija se osnova smatra vlastito izrađenim elektrolizatorom
Poznavajući vrste, ključne karakteristike, uređaj i princip rada ionskih instalacija, možete izvesti ispravnu montažu domaće konstrukcije koja je izvrstan asistent u različitim svakodnevnim situacijama: od zavarivanja i uštede potrošnje goriva motornih vozila do funkcioniranje sustava grijanja.
Uređaj i princip rada
Katoda i anoda
Najjednostavnije postrojenje za elektrolizu sastoji se od nekoliko "stanica", od kojih svaka uključuje:
- 2 pločaste elektrode - katoda (negativna) i anoda (pozitivna);
- Gumena brtva oko perimetra dviju susjednih različitih elektroda.
Vanjske stanice su opremljene posebnim cijevima kroz koje se ispušteni plinovi ispuštaju.
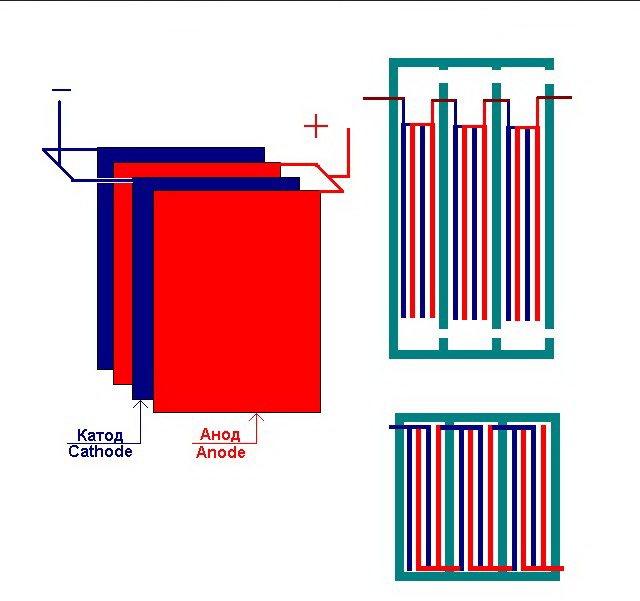

Nekoliko međusobno povezanih "stanica" postrojenja za elektrolizu
Elektrolizator može sadržavati od 1 do 30-40 ili više takvih "ćelija", istoimene ploče povezane su u seriju.
Važno! Kada se koriste napajanja izmjeničnom strujom, dodatno se koriste ispravljači, od kojih je najjednostavniji diodni most.
Takva instalacija radi na sljedeći način:
- Destilirana voda s otopljenom lužinom ili običnom sodom bikarbonom ulijeva se u prostor između elektroda;
- Napon od 1,8-2,0 V dovodi se iz napajanja na elektrode svih ćelija instalacije;
- Kao rezultat procesa elektrolize, negativno nabijenoj katodi privlače se anioni (pozitivno nabijeni ioni) tvari otopljene u vodi, uslijed čega se na njoj stvara tanki natrijev film;
- Na pozitivno nabijenoj anodi dolazi do uništavanja molekula vode, pri čemu svaka tvori 2 atoma vodika i 1 atom kisika;
- Oslobođeni detonirajući plin kroz odvojne cijevi ulazi u posudu koja mu je namijenjena.
Intenzitet procesa elektrolize ovisi o naponu i jakosti struje - pri malim vrijednostima ovih karakteristika postupak se neće nastaviti. Ako izvor napajanja daje struju s previsokim vrijednostima strujno-naponske karakteristike, otopina ulivena u elektrolizator bit će vrlo vruća i proključati.
Otklanjanje pogrešaka i testiranje uređaja
Zatim je potrebno utvrditi gdje vijci dodiruju zidove kutije i na tim mjestima izbušite dvije rupe. Ako se bez očitog razloga pokaže da vijci ne stanu u posudu, onda bi trebali izrežite i zategnite radi nepropusnosti maticama... Sada morate izbušiti poklopac i tamo umetnuti navojne spojnice s obje strane. Kako bi se osigurala nepropusnost, spoj treba zabrtviti brtvilom na bazi silikona.
Nakon što vlastitim rukama sastavite vlastiti elektrolizator, trebali biste ga testirati. Da biste to učinili, spojite uređaj na izvor napajanja, napunite ga vodom do vijaka, stavite na poklopac spajanjem cijevi na priključak i spuštanjem suprotnog kraja cijevi u vodu. Ako je struja slaba, tada će biti vidljiva iznutra u elektrolizatoru.
Postepeno povećavajte struju u vašem domaćem uređaju. Destilirana voda ne provodi dobro električnu energiju jer ne sadrži soli ili nečistoće. Za pripremu elektrolita potrebno je u vodu dodati lužinu. Da biste to učinili, morate uzeti natrijev hidroksid (sadržan u sredstvima za čišćenje cijevi kao što je "Mole"). Za sprečavanje nakupljanja pristojne količine plina potreban je sigurnosni ventil.
- Bolje je koristiti destiliranu vodu i soda kao katalizator.
- Trebali biste pomiješati dio sode bikarbone s četrdeset dijelova vode. Zidovi sa strane najbolje su izrađeni od akrilnog stakla.
- Elektrode su najbolje izrađene od nehrđajućeg čelika. Ima smisla koristiti zlato za tanjure.
- Za podlogu koristite prozirni PVC. Mogu biti veličine 200 puta 160 milimetara.
- Možete koristiti vlastiti elektrolizator koji ste sami izradili za kuhanje hrane za potpuno izgaranje benzina u automobilima iu većini slučajeva.
Suhi elektrolizatori uglavnom se koriste za strojeve. Generator povećava snagu motora s unutrašnjim izgaranjem. Vodik se zapali mnogo brže od tekućeg goriva, povećavajući silu klipa. Uz Mole, možete uzeti Mister Muscle, kaustičnu soda, sodu bikarbonu.
Generator ne radi na vodi za piće. Bolje je električnu energiju povezati ovako: prva i zadnja ploča - minus, a na ploči u sredini - plus. Što je veća površina ploča i što je jača struja, oslobađa se više plina.
Vrste elektrolizera
Uradi sam točkovno zavarivanje za baterije
Ovisno o dizajnu i principu rada, postoji 5 vrsta postrojenja za elektrolizu.
Suho
Takvi se elektrolizatori sastoje od pločastih elektroda odvojenih zatvorenim gumenim brtvama. Često su "ćelije" instalacije dodatno smještene u zatvoreni prostor.
Vodik i kisik koji nastaju kao rezultat elektrolize uklanjaju se kroz posebne odvojne cijevi smještene na kraju tijela ili krajnjim pločama instalacije.
Teče
Postrojenja za elektrolizu ovog tipa imaju sljedeći uređaj:
- Elektrolizna kupka (tijelo) s dvije mlaznice, kroz koju se u nju dovodi elektrolit, kroz drugu se ispušta detonirajući plin nastao kao rezultat elektrolize;
- Pločaste elektrode odvojene odstojnicima;
- Spremnik s elektrolitom smješten iznad kućišta s elektrodama i povezan crijevima s odvojnim cijevima elektrolizne kupke postrojenja i koji u gornjem dijelu ima odvojnu cijev s plinskim ventilom.
Tijekom rada takvog uređaja, razvijeni plin kroz odvojnu cijev i crijevo ulazi u spremnik s elektrolitom i stvarajući u njemu određeni tlak napušta instalaciju kroz ventil na odvojnoj cijevi.
Membrana
Stanice za elektrolizu takvih postrojenja sastoje se od dvije elektrode odvojene tankom membranom koja omogućuje prolazak proizvoda elektrolize i odvaja elektrode jedna od druge.
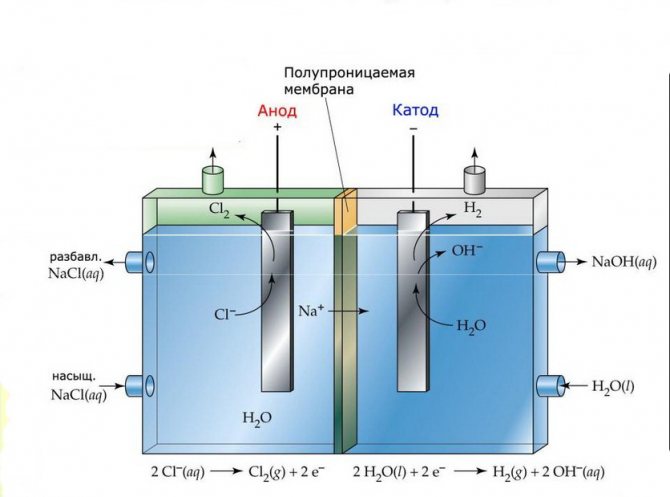

Postrojenje membranske elektrolize
Dijafragma
Postrojenja za elektrolizu ovog tipa sastoje se od tikvice u obliku slova "U" s dvije umetnute elektrode i 2-3 nepropusne dijafragme. Slični elektrolizatori koriste se za odvojenu proizvodnju čistog vodika i kisika.
Alkalna
Za razliku od ostalih modela elektrolizera, u njima se lužnata otopina koristi kao elektrolit - kaustična soda (natrijev hidroksid), koja nije samo dodatni izvor vodika i kisika, već i katalizator za elektrolizu.
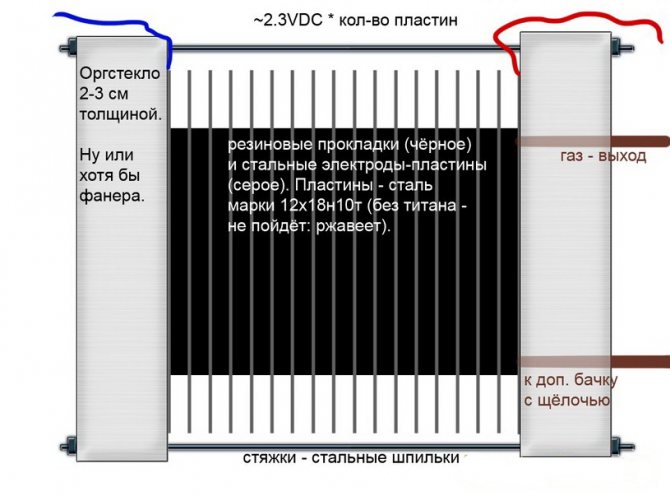

Alkalni krug elektrolizera
Takve instalacije, za razliku od analoga drugih vrsta, omogućuju upotrebu jeftinijih elektroda izrađenih od običnog željeza.
Učinite elektrolizator vlastitim rukama
Sigurno vam je poznat postupak elektrolize iz kurikuluma osnovne škole. To je kada se dvije polarne elektrode stave u vodu pod strujom kako bi se dobili metali ili nemetali u čistom obliku. Elektrolizator je potreban za razgradnju molekula vode u kisik i vodik. Elektrolizator, kao dio znanstvenih mehanizama, dijeli molekule u ione.
Postoje dvije vrste ovog uređaja:
- Suhi elektrolizator (ovo je potpuno zatvorena ćelija);
- Mokri elektrolizator (to su dvije metalne pločice smještene u posudu s vodom).
Ovaj je uređaj jednostavan u smislu uređaja, što ga čini mogućim koristiti čak i kod kuće... Elektrolizatori dijele naboje elektrolize atoma molekula u nabijene atome.
U našem slučaju on dijeli vodu na pozitivan vodik i negativni kisik. Da bi se to učinilo potrebna je velika količina energije, a da bi se smanjila potrebna količina energije, koristi se katalizator.
Elektrolizator za proizvodnju vodika
Proračun uzemljenja
Kako biste vlastitim rukama sastavili najjednostavniji elektrolizator, možete se poslužiti crtežom prikazanim na slici.
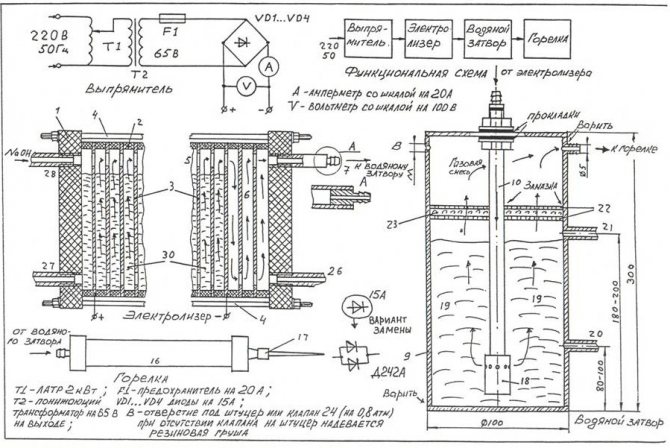

Crtež najjednostavnijeg domaćeg elektrolizera
Bilješka! Elektrolizator je prilično opasna instalacija koja tijekom rada plinoviti kisik, koji se nakuplja u velikim količinama, može izazvati ozbiljnu eksploziju. Uređaj se ne smije nalaziti u blizini izvora otvorene vatre, uređaja za grijanje.
Uradi sam elektrolizator za automobil
Da bi se poboljšalo izgaranje goriva u automobilskom motoru, često se sastavlja elektrolizator koji se sastoji od kućišta od stare baterije s pločicama od nehrđajućeg čelika smještenih unutra, dvije mlaznice, od kojih je jedna spojena na spremnik napunjen elektrolitom, a drugi je spojen na crijevo za dovod zraka na motor (točnije, s valovitim od usisa za zrak do filtra za zrak).
Takav domaći protočni elektrolizator napaja se iz akumulatora automobila pomoću releja i osigurača od 10 A.
Stvaramo uređaj vlastitim rukama
Uređaj za ovaj postupak može se izraditi ručno.
Za ovo će vam trebati:
- Lim od nehrđajućeg čelika;
- Vijci M6 x 150;
- Podloške;
- Matice;
- Prozirna cijev;
- Povezivanje elemenata navojem s obje strane;
- Plastična posuda od jedne i pol litre;
- Filter za vodu;
- Nepovratni ventil za vodu.
Izvrsna opcija za nehrđajući čelik je AISI 316L stranog proizvođača ili 03X16H15M3 proizvođača iz naše zemlje. Nema apsolutno potrebe za kupnjom nehrđajućeg čelika, možete uzeti stari. Dovoljno vam je 50 do 50 centimetara.
"Zašto uzimati sam nehrđajući čelik?" - pitaš. Budući da će najčešći metal nagrizati. Nehrđajući čelik bolje podnosi lužine. Trebao bi ocrtajte list na takav način da ga podijelite na 16 sličnih kvadrata... Možete ga rezati kutnom brusilicom. Na svakom kvadratu izrežite jedan od uglova.
Na drugoj strani i nasuprotnom kutu, iz piljenog kuta, izbušite rupu za vijak koji će vam pomoći da ploče držite zajedno. Elektrolizator ne prestaje raditi ovako:t ploča struja teče na ploču - i voda se raspada na kisik i vodik. Zahvaljujući tome, trebamo dobru i negativnu ploču.
Ploče moraju biti povezane naizmjenično: plus-minus-plus-minus, kod slične metode bit će jaka struja. Za izolaciju ploča jednu od jedne koristi se cijev. Prsten je izrezan od razine. Njenim rezanjem dobivamo traku debljine milimetra. Ova je udaljenost ispravnija za stvaranje plina.
Ploče su međusobno povezane podloškama: na vijak smo postavili podlošku, zatim ploču i tri podloške, pa opet ploču i tako dalje. Na plus i minus mora se zasaditi osam ploča. Ako je sve učinjeno ispravno, tada rezovi ploča neće dodirivati elektrode.
Zatim morate zategnuti matice i izolirati ploče. Zatim stavimo strukturu u plastičnu posudu.
Pregled proizvođača elektrolizera
Glavni proizvođači elektrolizatora su oba domaća poduzeća (RUSAL, NPF RutTech, JSC Uralkhimmash), kao i njihovi inozemni konkurenti - Teledyne Energy Systems, Inc (SAD), Hydrogenics Corp. (Belgija).
Dakle, elektrolizator je prilično jednostavna i značajkama bogata instalacija koja se koristi za proizvodnju plina kisika, koji se u budućnosti planira koristiti kao gorivo za motore s unutarnjim izgaranjem i kotlove za grijanje.
Uradi sam kućnu elektrolizu
Kad sam bila mala, uvijek sam htjela nešto napraviti sama, svojim rukama. Ali roditelji (i drugi bliski ljudi) to u većini slučajeva nisu dopuštali. I tada nisam vidio (a ni do sada ne vidim) ništa loše kad mala djeca žele učiti ??
Naravno, nisam ovaj članak napisao kako bih se prisjetio iskustava iz djetinjstva u želji da započnem samoobrazovanje. Slučajno, dok sam surfao Internetom, naišao sam na pitanje ove vrste. Neki mali dječak bombarder postavljao je pitanja kako raditi elektrolizu kod kuće. Istina, nisam mu odgovorio, jer je ovaj dječak htio elektrolizirati bolno sumnjivu smjesu ?? Odlučio sam da neću reći dalje iz grijeha, pustite da i sam pogledam u knjige. Ali ne tako davno, ponovno lutajući forumima, vidio sam slično pitanje učitelja u kemijskoj školi. Sudeći prema opisu, njegova je škola toliko siromašna da ne može (ne želi) kupiti elektrolizator za 300 rubalja. Učitelj (kakav problem!) Nije mogao pronaći izlaz iz nastale situacije. Pa sam mu pomogla. Za one koji su znatiželjni o ovoj vrsti domaćih proizvoda, objavljujem ovaj članak na web mjestu.
Zapravo, postupak proizvodnje i uporaba naše samopalete vrlo je primitivan. Ali prije svega reći ću vam o sigurnosti, a o proizvodnji - u drugom. Stvar je u tome što govorimo o demonstracijskom elektrolizatoru, a ne o industrijskoj instalaciji. Zahvaljujući tome, za sigurnost će biti dobro napajati ga ne iz mreže, već iz AA baterija ili iz baterije. Prirodno, što je veći napon, to će proces elektrolize ići brže. Međutim, za vizualno promatranje mjehurića plina to je sasvim dovoljno 6 V, ali 220 je već pretjerano. s takvim naponom, primjerice, voda će najbrže kipjeti, a ovo nije baš sigurno ... Pa, mislim da ste skužili napetost?
Sada razgovarajmo o tome gdje ćemo i pod kojim uvjetima eksperimentirati. Prva stvar, to bi trebao biti ili slobodni prostor ili dobro prozračena soba. Iako sam sve radio u stanu sa zatvorenim prozorima i nimalo slično? Drugo, pokus je najbolje provesti na dobrom stolu. Riječ "dobar" znači da stol mora biti stabilan, a bolje težak, krut i pričvršćen na podnu površinu. U tom slučaju pokrivač stola mora biti otporan na agresivne tvari. Usput, pločica s pločice savršena je za to (iako ne svaka, nažalost). Ovakav stol dobro će doći ne samo za ovo iskustvo. Međutim, sve sam radio na običnoj stolici ?? Treće, tijekom eksperimenta ne trebate pomicati izvor napajanja (u mom slučaju baterije). Zahvaljujući tome, zbog pouzdanosti, najbolje je odmah ih položiti na stol i popraviti tako da ne popuštaju. Vjerujte mi, ovo je prikladnije nego ih redovito držati rukama. Jednostavno sam svoje baterije vezao električnom trakom za prvi tvrdi predmet koji sam vidio. Četvrto, jela u kojima ćemo eksperimentirati, neka budu mala. Jednostavno staklo stane ili čaša. Inače, ovo je najoptimalniji način korištenja naočala kod kuće, za razliku od ulijevanja alkohola u njih uz daljnju upotrebu ...
E, sad, prijeđimo konkretno na uređaj. Navedeno je na slici, ali za sada ću ukratko objasniti što i što.
Moramo uzeti jednostavnu olovku i s nje običnim nožem ukloniti stablo i iz olovke izvaditi cijeli olovo. Međutim, možete preuzeti vodstvo od mehaničke olovke. Ali dvije su poteškoće odjednom. Prva je uobičajena. Olovo mehaničke olovke je pretanko, za nas to jednostavno nije prikladno za vizualni eksperiment. Druga poteškoća je neki nerazumljivi sastav trenutnih škriljevaca. Čini se kao da nisu izrađeni od grafita, već od nečeg drugog. Općenito, moje iskustvo s takvim "olovom" uopće nije bilo uspješno, čak ni pri naponu od 24 V. Zahvaljujući tome, trebao sam odabrati dobru drvenastu jednostavnu olovku. Rezultirajuća grafitna šipka služit će nam kao elektroda. Kao što možete zamisliti, trebaju nam dvije elektrode. Zahvaljujući tome, idemo odabrati drugu olovku ili jednostavno slomiti postojeću šipku na dva dijela. Zapravo sam ovo učinila.
Bilo kojom žicom koja nam dođe pod ruku, omotamo prvu elektrodu s olovom (s jednim krajem žice) i tu žicu povežemo s minusom izvora napajanja (s drugim krajem). Tada preuzimamo drugo vodstvo i činimo isto s njim. Za ovo, na temelju ovoga, trebamo drugu žicu. Ali u ovom slučaju, ovu žicu povezujemo s plusom napajanja. Ako imate problema s pričvršćivanjem krhke grafitne šipke na žicu, možete upotrijebiti priručni alat kao što je traka ili selotejp. Ako vrh grafita nije uspjelo omotati samom žicom, a traka ili izolacijska traka nisu osigurale čvrst kontakt, pokušajte zalijepiti olovo vodljivim ljepilom. Ako ovo nemate, onda barem vodite nit na žicu. Ne treba se bojati, nit neće izgorjeti od takve napetosti ??
Za one koji ne znaju ništa o baterijama i jednostavnim pravilima njihovog povezivanja, objasnit ću malo. Prstna baterija proizvodi napon od 1,5 V. Na slici imam dvije slične baterije. Štoviše, povezani su postepeno - jedno za drugim, a ne paralelno. Sa sličnom (serijskom) vezom konačni napon zbrajat će se iz napona svake baterije, odnosno za mene je 1,5 + 1,5 = 3,0 V. To je manje od prethodno navedenih 6 volti. Ali bila sam lijena otići kupiti još nekoliko baterija. Načelo ti i tako mora biti jasno ??
Krenimo s eksperimentom. Primjerice, ograničit ćemo se na elektrolizu vode.Prvo, vrlo je dostupan (nadam se da čitatelj ovog članka ne živi u Sahari), i drugo, bezopasan je. Štoviše, pokazat ću kako s istim uređajem (elektrolizatorom) s istom tvari (vodom) izvesti dva raznim iskustvo. Mislim da imate dovoljno mašte da smislite hrpu sličnih pokusa s drugim tvarima ?? Općenito nam je voda iz slavine pogodna. Ali preporučujem da ga dodate malo više i posolite. Malo - to znači malu prstohvat, a ne cijelu žličicu za desert. Ovo je važno! Dobro promiješajte sol da se otopi. Tako će voda, budući da je dielektrik u čistom stanju, savršeno voditi električnu energiju. na početku eksperimenta obrišite stol od potencijalne vlage, a zatim na njega stavite izvor napajanja i čašu vode.
Spuštamo obje elektrode prisutne pod naponom u vodu. Istodobno pazite da u vodu bude uronjen samo grafit, a sama žica ne smije dodirivati vodu. Početak eksperimenta može se odgoditi. Vrijeme ovisi o mnogim pokazateljima: o sastavu vode, kvaliteti žica, kvaliteti grafita i, naravno, naponu izvora napajanja. Početak moje reakcije odgodio se na nekoliko sekundi. Kisik počinje razvijati na elektrodi koja je bila povezana s plusom baterija. Vodik će se osloboditi na elektrodi spojenoj na minus. Treba napomenuti da ima više mjehurića vodika. Vrlo mali mjehurići se lijepe oko dijela grafita koji je uronjen u vodu. Tada neki mjehurići počnu plutati.
Elektroda na početku eksperimenta. Još nema mjehurića plina. Mjehurići vodika nastali su na elektrodi spojenoj na negativni pol baterija
Koji još eksperimenti mogu biti? Ako ste se već dovoljno poigrali s vodikom i kisikom, nastavljamo s drugim eksperimentom. Zanimljivije je, posebno za domaće istraživače. Zanimljiv je po tome što ga je moguće ne samo vidjeti, već i namirisati. U prošlom smo iskustvu dobili kisik i vodik, koji po mom mišljenju nisu baš spektakularni. A u drugom pokusu dobivamo dvije tvari (inače korisne u svakodnevnom životu). na početku eksperimenta zaustavite prethodni eksperiment i osušite elektrode. Sada uzmite kuhinjsku sol (koju obično koristite u kuhinjskoj sobi) i otopite je u vodenoj masi. U ovom slučaju, ne mali iznos. Zapravo je pristojna količina soli jedino što drugo iskustvo razlikuje od prvog. Nakon otapanja soli možete odmah ponoviti pokus. Sada se odvija drugačija reakcija. Na dobroj elektrodi sada se ne oslobađa kisik, već klor. A negativno se oslobađa i vodik. Što se tiče čaše u kojoj se nalazi otopina soli, u njoj nakon dulje elektrolize ostaje natrijev hidroksid. Ovo je poznata kaustična soda, alkalija.
Klor, moći ćete ga osjetiti. Ali za najbolji učinak, preporučujem uzimanje napona od najmanje 12 V. Inače možda nećete osjetiti aromu. Prisutnost lužine (nakon vrlo duge elektrolize) u staklu može se provjeriti na nekoliko načina. Najjednostavnije i najnasilnije je staviti ruku u čašu. Etnički predznak kaže da u čaši ima alkalije ako započne peckanje. Pametniji i razgovijetniji način je lakmusov test. Ako je vaša škola toliko siromašna da čak nije u stanju steći ni lakmus, pomoći će vam prikladni pokazatelji. Jedan od njih, kako kažu, može poslužiti kao kap soka od repe ?? No, sasvim je moguće u otopinu ukapati malo masti. Koliko znam, saponifikacija bi se trebala dogoditi.
Za vrlo znatiželjne, opisat ću što se zapravo dogodilo tijekom eksperimenata. U prvom se eksperimentu pod utjecajem električne struje dogodila slična reakcija: 2 H2O >>> 2 H2 + O2 Oba plina prirodno plutaju iz vode na površinu. Usput, plutajući plinovi mogu biti zarobljeni. Hoćete li to moći sami učiniti?
U drugom eksperimentu reakcija je bila potpuno drugačija.Pokrenula ga je i električna struja, ali sada nije reagirala samo voda, već i sol: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Imajte na umu da se reakcija mora odvijati u suvišku vode. Da biste saznali koja se količina soli smatra najvećom, možete je izbrojati iz gornje reakcije. Još uvijek možete razmišljati o tome kako poboljšati uređaj ili koje druge eksperimente možete napraviti. Uistinu, moguće je da se natrijev hipoklorit može dobiti elektrolizom. U laboratorijskim uvjetima, u većini slučajeva, dobiva se propuštanjem plinovitog klora kroz otopinu natrijevog hidroksida.