Viens no daudzajiem fizikāli ķīmiskajiem procesiem, kas ir plaši izmantots gan rūpniecībā, gan ikdienas dzīvē, ir elektrolīze - elektrodu, kas savienoti ar strāvas avotu, ievietoti šķīdumā vai kausējumā, to sastāvdaļu (tīra metāla - alumīnija) atlase , varš, gāze utt.). Galvenā instalācija, kurā notiek šis process, ir elektrolizators.

Elektrolizators
Kas ir elektrolizators
Elektrolizators ir īpaša iekārta, ko izmanto, lai atdalītu tā sastāvdaļas no šķīduma vai kausējuma.
Elektrolizatora galvenās īpašības ir:
- Viena elektroda darba spriegums svārstās no 1,8 līdz 2,0 V;
- Strāvas stiprums - normālai elektrolīzes procesa norisei elektrodiem tiek piegādāta strāva ar šī raksturlieluma vērtību no 5 līdz 10 A;
- Elektrodu skaits - minimālais elektrodu skaits ir 2, maksimālo ierobežo pašas instalācijas lielums un tā mērķis;
- Elektrodu izmēri - par elektrodiem tiek izmantoti nevis oglekļa stieņi, bet gan metāla plāksnes, kuru izmēru nosaka uzstādīšanas mērķis, plāksnēm pievadītās strāvas strāvas sprieguma raksturlielums;
- Attālums starp pretēji uzlādētām elektrodu virsmām - minimālajam attālumam starp elektrodu plāksnēm jābūt vismaz 1,5 mm;
- Elektrodu materiāls - mūsdienu elektrolizatoros nerūsējošā tērauda loksne ar niķeli tiek izmantota kā materiāls anodam un katodam.
Vēl viena svarīga elektrolīzes iekārtas īpašība ir katalizatoru izmantošana.
Šādas iekārtas tiek izmantotas šādiem mērķiem:
- Oksidūdeņraža gāzes iegūšana, kas sastāv no ūdeņraža un skābekļa maisījuma (Brauna gāze);
- Tīra alumīnija, magnija, cinka izolēšana no to sāls kūst;
- Ūdens attīrīšana no sāļiem un tajā izšķīdušiem piemaisījumiem;
- Plāna niķeļa, cinka uzklāšana, kas novērš koroziju uz metāla detaļu virsmas;
- Pārtikas produktu dezinfekcija;
- Notekūdeņu attīrīšana no izšķīdušiem smago metālu sāļiem un citām kaitīgām vielām.
Svarīgs! No parastā dzelzs izgatavotu platīna elektrodu elektrolīzes iekārtās izmanto retāk nekā no nerūsējošā tērauda, jo tas ātrāk oksidējas un kļūst nelietojams.
Pašu izgatavots elektrolizators
Ikviens var izgatavot elektrolizatoru ar savām rokām. Visizplatītākā dizaina montāžas procesam būs nepieciešami šādi materiāli:
- nerūsējošā tērauda loksne (labākās iespējas ir ārzemju AISI 316L vai mūsu 03X16H15M3);
- skrūves М6х150;
- paplāksnes un uzgriežņi;
- caurspīdīga caurule - jūs varat izmantot līmeņrādi, kas tiek izmantots būvniecības vajadzībām;
- vairākas siļķu kaula armatūras ar ārējo diametru 8 mm;
- plastmasas trauks ar tilpumu 1,5 litri;
- mazs filtrs, kas filtrē krāna ūdeni, piemēram, veļas mašīnu filtrs;
- pretvārsts ūdens vārsts.
Montāžas process
Savāciet elektrolizatoru ar savām rokām saskaņā ar šādiem norādījumiem:
- Pirmkārt, jums ir jāmarķē un tam sekojošā nerūsējošā tērauda loksnes zāģēšana identiskos laukumos. Zāģēšanu var veikt ar leņķa slīpmašīnu (leņķa slīpmašīnu). Viens no stūriem šādos laukumos ir jānogriež leņķī, lai pareizi nostiprinātu plāksnes;
- Tālāk jums jāizveido caurums skrūvei plāksnes pusē, kas atrodas pretī stūra zāģa griezumam;
- Plātņu savienojums jāveic pēc kārtas: viena plāksne uz "+", nākamā uz "-" un tā tālāk;
- Starp atšķirīgi uzlādētajām plāksnēm jābūt izolatoram, kas darbojas kā caurule no ūdens līmeņa.To vajadzētu sagriezt gredzenos, kurus vajadzētu sagriezt gareniski, lai iegūtu 1 mm biezas sloksnes. Šis attālums starp plāksnēm ir pietiekams, lai elektrolīzes laikā notiktu laba gāzes attīstība;
- Plāksnes tiek piestiprinātas kopā, izmantojot paplāksnes, šādi: uz skrūves atrodas paplāksne, pēc tam plāksne, pēc tam trīs paplāksnes pēc plāksnes utt. Labvēlīgi uzlādētas plāksnes ievieto negatīvi uzlādētu lokšņu spoguļattēlā. Tas ļauj neļaut zāģētajām malām pieskarties elektrodiem;


Elektrolīzes rūpnīcas plāksnes, kas samontētas kopā
- Montējot plāksnes, jums tās vienlaikus jāizolē un jāpievelk uzgriežņi;
- Katrai plāksnei jābūt arī gredzenotai, lai pārliecinātos, ka nav īssavienojuma;
- Tālāk visa montāža jāievieto plastmasas kastē;
- Pēc tam ir vērts izcelt vietas, kur skrūves pieskaras konteinera sienām, kur jūs urbjat divas atveres. Ja skrūves neietilpst traukā, tad tās jāapgriež ar zāģi;
- Tad skrūves tiek pievilktas ar uzgriežņiem un paplāksnēm, lai nodrošinātu konstrukcijas blīvumu;


Plāksnes ievietotas plastmasas traukā
- Pēc veiktajām darbībām konteinera vākā būs jāizveido atveres un tajās jāievieto armatūra. Necaurlaidību šajā gadījumā var nodrošināt, savienojumus noblīvējot ar hermētiķiem uz silikona bāzes;
- Drošības vārsts un filtrs konstrukcijā atrodas pie gāzes izplūdes un kalpo kā līdzeklis, lai kontrolētu pārmērīgu gāzes uzkrāšanos, kas var izraisīt sliktus rezultātus;
- Elektrolīzes mezgls ir samontēts.
Pēdējais posms ir tests, kas tiek veikts līdzīgi:
- tvertnes piepildīšana ar ūdeni līdz stiprinājumu skrūvju atzīmei;
- strāvas savienošana ar ierīci;
- savienojums ar caurules stiprinājumu, kura pretējais gals ir nolaists ūdenī.
Ja instalācijai tiek piemērota vāja strāva, tad gāzes izvadīšana caur cauruli būs gandrīz nemanāma, taču to būs iespējams vērot no elektrolizatora iekšpuses. Palielinot maiņstrāvu, ūdenim pievienojot sārmainu katalizatoru, gāzes izlaidi var ievērojami palielināt.
Izgatavotais elektrolizators parasti ir svarīga daudzu ierīču sastāvdaļa, piemēram, ūdeņraža deglis.


ūdeņraža degļa izskats, kura pamats tiek uzskatīts par pašu izgatavotu elektrolizatoru
Zinot jonu instalāciju veidus, galvenos raksturlielumus, ierīci un darbības principu, jūs varat pareizi veikt mājās izgatavotas konstrukcijas montāžu, kas ir lielisks palīgs dažādās ikdienas situācijās: sākot no metināšanas un automobiļu degvielas patēriņa taupīšanas līdz pat apkures sistēmu darbību.
Ierīce un darbības princips
Katods un anods
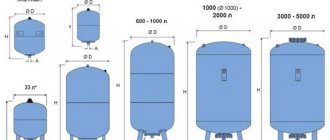
Vienkāršākā elektrolīzes iekārta sastāv no vairākām "šūnām", no kurām katra ietver:
- 2 plākšņu elektrodi - katods (negatīvs) un anods (pozitīvs);
- Gumijas starplika ap blakus esošo atšķirīgo elektrodu perimetru.
Ārējās šūnas ir aprīkotas ar īpašām caurulēm, pa kurām izvadītās gāzes tiek izvadītas.
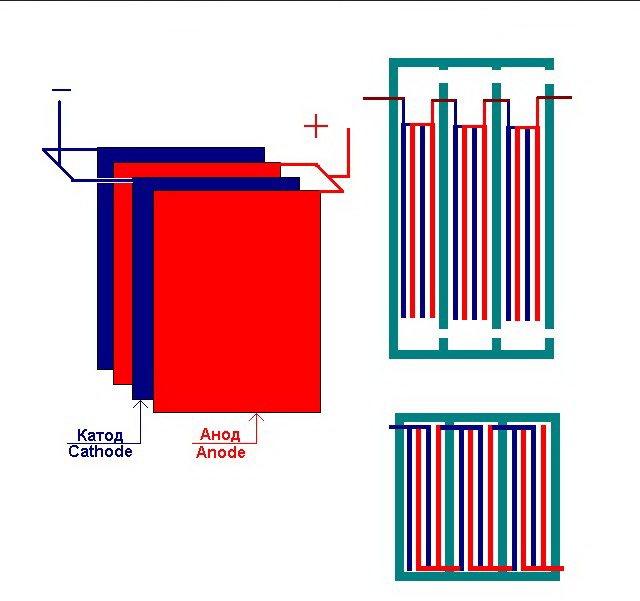

Vairākas savstarpēji savienotas elektrolīzes rūpnīcas "šūnas"
Elektrolizators var saturēt no 1 līdz 30-40 vai vairāk šādu "šūnu", tā paša nosaukuma plāksnes ir savienotas virknē.
Svarīgs! Izmantojot barošanas avotus ar maiņstrāvu, papildus tiek izmantoti taisngrieži, no kuriem vienkāršākais ir diodes tilts.
Šāda instalācija darbojas šādi:
- Starp elektrodiem telpā ielej destilētu ūdeni ar tajā izšķīdinātu sārmu vai parasto cepamo soda;
- Visu iekārtas elementu elektrodiem no barošanas avota tiek piegādāts 1,8-2,0 V spriegums;
- Elektrolīzes procesa rezultātā ūdenī izšķīdinātas vielas anjoni (pozitīvi uzlādēti joni) tiek piesaistīti negatīvi lādētajam katodam, kā rezultātā uz tā veidojas plāna nātrija plēve;
- Uz pozitīvi lādēta anoda notiek ūdens molekulu iznīcināšana, savukārt no katra veidojas 2 ūdeņraža atomi un 1 skābekļa atoms;
- Caur filiāles caurulēm izdalītā detonējošā gāze nonāk tam paredzētajā traukā.
Elektrolīzes procesa intensitāte ir atkarīga no sprieguma un strāvas stipruma - pie zemām šo raksturlielumu vērtībām process neturpināsies. Ja strāvas avots piegādā strāvu ar pārāk lielām strāvas sprieguma raksturlieluma vērtībām, elektrolizatorā ielejamais šķīdums būs ļoti karsts un vārīsies.
Atkļūdošana un ierīces pārbaude
Tad ir jānosaka, kur skrūves pieskaras kastes sienām, un šajās vietās urbj divas atveres. Ja bez redzama iemesla izrādās, ka skrūves neiederas traukā, tad tām vajadzētu sagrieziet un pievelciet cieši ar uzgriežņiem... Tagad jums ir jāizurbj vāks un jāievieto vītņotie savienotāji tur no abām pusēm. Lai nodrošinātu necaurlaidību, savienojums ir jāaizver ar silikona bāzes hermētiķi.
Pēc sava elektrolizatora salikšanas ar savām rokām jums tas jāpārbauda. Lai to izdarītu, pievienojiet ierīci strāvas avotam, piepildiet to ar ūdeni līdz skrūvēm, uzlieciet vāku, savienojot cauruli ar savienotājelementu un nolaižot caurules pretējo galu ūdenī. Ja strāva ir vāja, strāva būs redzama no elektrolizatora iekšpuses.
Soli pa solim palieliniet mājās gatavotās ierīces jaudu. Destilēts ūdens slikti vada elektrību, jo tajā nav sāļu un piemaisījumu. Lai sagatavotu elektrolītu, ūdenim jāpievieno sārmi. Lai to izdarītu, jums jālieto nātrija hidroksīds (satur līdzekļus cauruļu tīrīšanai, piemēram, "Mole"). Drošības vārsts ir nepieciešams, lai novērstu pienācīgu gāzes daudzumu uzkrāšanos.
- Kā katalizatoru labāk izmantot destilētu ūdeni un soda.
- Jums vajadzētu sajaukt daļu cepamā soda ar četrdesmit daļām ūdens. Sienas no sāniem vislabāk ir izgatavotas no akrila stikla.
- Elektrodi vislabāk ir izgatavoti no nerūsējošā tērauda. Plātnēm ir jēga izmantot zeltu.
- Pamatnei izmantojiet caurspīdīgu PVC. To izmērs var būt 200 līdz 160 milimetri.
- Pārtikas pagatavošanai, benzīna pilnīgai sadedzināšanai automašīnās un vairumā gadījumu varat izmantot savu pašu izgatavotu elektrolizatoru.
Sausos elektrolizatorus galvenokārt izmanto mašīnām. Ģenerators palielina iekšdedzes dzinēja jaudu. Ūdeņradis aizdegas daudz ātrāk nekā šķidrā degviela, palielinot virzuļa spēku. Papildus Mole varat lietot Mister Muscle, kaustisko soda, cepamo soda.
Ģenerators nedarbojas ar dzeramo ūdeni. Labāk ir savienot elektrību šādi: pirmā un pēdējā plāksne - mīnus, un uz plāksnes vidū - plus. Jo lielāks ir plākšņu laukums un jo spēcīgāka ir strāva, jo vairāk izdalās gāze.
Elektrolizatoru veidi
DIY punktmetināšana baterijām
Atkarībā no konstrukcijas un darbības principa ir 5 veidu elektrolīzes iekārtas.
Sauss
Šādi elektrolizatori sastāv no plāksnīšu veida elektrodiem, kas atdalīti ar noslēgtām gumijas starplikām. Bieži vien instalācijas "šūnas" papildus ievieto noslēgtā korpusā.
Ūdeņradis un skābeklis, kas radies elektrolīzes rezultātā, tiek noņemts caur īpašām atzarojuma caurulēm, kas atrodas korpusa galā vai iekārtas galējās plāksnēs.
Plūstošs
Šāda veida elektrolīzes iekārtām ir šāda ierīce:
- Elektrolīzes vanna (korpuss) ar divām sprauslām, caur kurām vienā tiek ievadīts elektrolīts, caur otro tiek izvadīta detonējošā gāze, kas izveidojusies elektrolīzes rezultātā;
- Plākšņu elektrodi, kas atdalīti ar starplikām;
- Tvertne ar elektrolītu, kas atrodas virs korpusa ar elektrodiem un ar šļūtenēm savienota ar iekārtas elektrolīzes vannas atzarojuma caurulēm un kam augšējā daļā ir atzarojuma caurule ar gāzes vārstu.
Šādas ierīces darbības laikā attīstījusies gāze caur filiāles cauruli un šļūtene ar elektrolītu nonāk tvertnē un, radot tajā zināmu spiedienu, atstāj instalāciju caur vārstu uz filiāles caurules.
Membrāna
Šādu iekārtu elektrolīzes šūnas sastāv no diviem elektrodiem, kas atdalīti ar plānu membrānu, kas ļauj elektrolīzes produktiem iziet cauri un atdala elektrodus viens no otra.
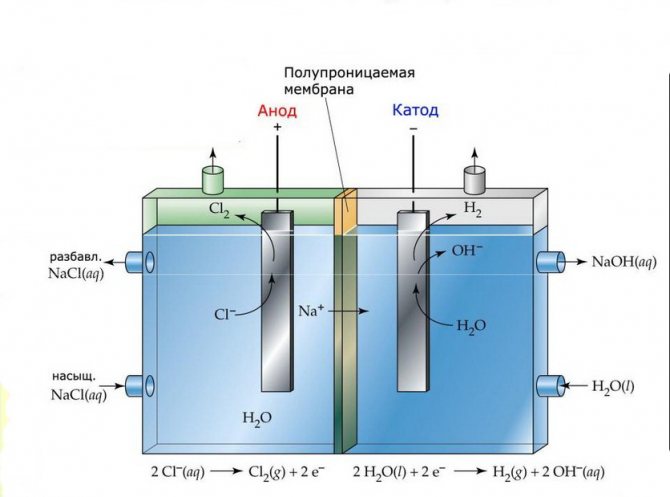

Membrānas elektrolīzes iekārta
Diafragma
Šāda veida elektrolīzes iekārtas sastāv no "U" formas kolbas, kurā ievietoti divi elektrodi, un 2-3 necaurlaidīgām diafragmām. Līdzīgus elektrolizatorus izmanto tīra ūdeņraža un skābekļa atsevišķai ražošanai.
Sārmains
Atšķirībā no citiem elektrolizatoru modeļiem šajos sārma šķīdumu izmanto kā elektrolītu - kaustisko soda (nātrija hidroksīdu), kas ir ne tikai papildu ūdeņraža un skābekļa avots, bet arī elektrolīzes katalizators.
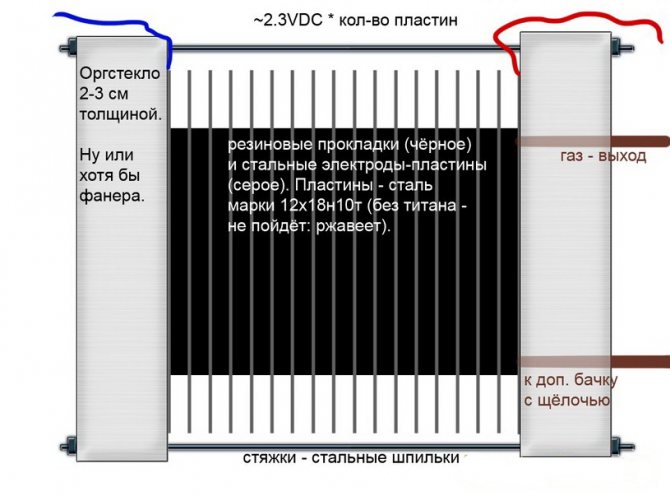

Sārmaina elektrolizatora ķēde
Šādas iekārtas, atšķirībā no cita veida analogiem, ļauj izmantot lētākus elektrodus, kas izgatavoti no parastā dzelzs.
Veiciet elektrolizatoru ar savām rokām
Protams, jūs esat iepazinies ar elektrolīzes procesu no pamatskolas mācību programmas. Tas ir tad, kad 2 polāros elektrodus ievieto strāvas ūdenī, lai iegūtu tīrā veidā metālus vai nemetālus. Elektrolizators ir nepieciešams ūdens molekulu sadalīšanai skābeklī un ūdeņradī. Elektrolizators kā daļa no zinātniskiem mehānismiem sadala molekulas jonos.
Ir divi šīs ierīces veidi:
- Sauss elektrolizators (tas ir pilnīgi slēgts elements);
- Mitrs elektrolizators (tās ir divas metāla plāksnes, kas ievietotas traukā ar ūdeni).
Šī ierīce ir vienkārša ierīces ziņā, kas to ļauj izmantot pat mājās... Elektrolizatori sadala molekulu atomu elektrolīzes lādiņus lādētos atomos.
Mūsu gadījumā tas sadala ūdeni pozitīvā ūdeņradī un negatīvajā skābeklī. Lai to izdarītu, nepieciešams liels enerģijas daudzums, un, lai iegūtu mazāk vajadzīgās enerģijas, tiek izmantots katalizators.
Elektrolizators ūdeņraža ražošanai
Zemējuma aprēķins
Lai ar savām rokām saliktu vienkāršāko elektrolizatoru, varat izmantot zīmējumu, kas parādīts attēlā.
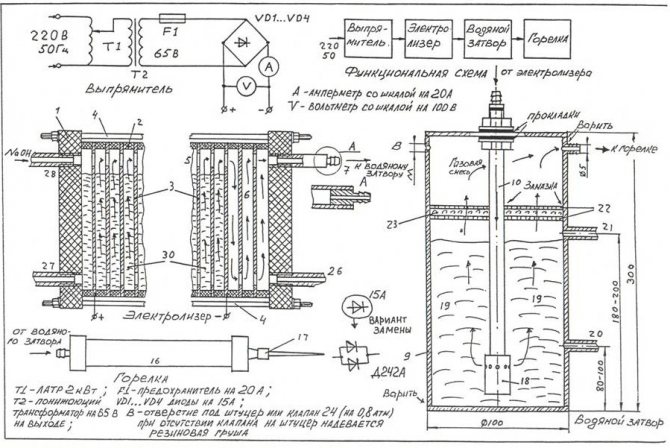

Vienkāršākā pašmāju elektrolizatora rasējums
Piezīme! Elektrolizators ir diezgan bīstama iekārta, kas darbības laikā oksihidrogēna gāze, kas uzkrājas lielos daudzumos, var izraisīt nopietnu eksploziju. Iekārtu nedrīkst novietot tuvu atklātas uguns avotiem, sildierīcēm.
DIY elektrolizators automašīnai
Lai uzlabotu degvielas sadegšanu automašīnas motorā, bieži tiek montēts elektrolizators, kas sastāv no vecas akumulatora korpusa ar iekšpusē ievietotām nerūsējošā tērauda plāksnēm, divām sprauslām, no kurām viena ir savienota ar tvertni, kas piepildīta ar elektrolītu, otra savienots ar gaisa padeves šļūteni motoram (precīzāk, ar gofrētu no gaisa ieplūdes līdz gaisa filtram).
Šāds mājās gatavots plūstošs elektrolizators tiek darbināts no automašīnas akumulatora, izmantojot releju un 10 A drošinātāju.
Mēs izveidojam ierīci ar savām rokām
Ierīci šim procesam var izdarīt ar rokām.
Tam jums būs nepieciešams:
- Nerūsējošā tērauda loksne;
- Skrūves M6 x 150;
- Paplāksnes;
- Rieksti;
- Caurspīdīga caurule;
- Savienojošie elementi ar vītni abās pusēs;
- Pusotra litra plastmasas trauks;
- Ūdens filtrs;
- Pretvārsts ir ūdens.
Lieliska nerūsējošā tērauda iespēja ir ārvalstu ražotāja AISI 316L vai mūsu valsts ražotāja 03X16H15M3. Nerūsējošais tērauds nav absolūti nepieciešams, jūs varat ņemt veco. Jums pietiek ar 50 līdz 50 centimetriem.
"Kāpēc ņemt pašu nerūsējošo tēraudu?" - tu jautā. Tā kā visbiežāk sastopamais metāls korozēs. Nerūsējošais tērauds labāk panes sārmus. Vajadzētu izklāstiet lapu tā, lai to sadalītu 16 līdzīgos laukumos... Jūs to varat sagriezt ar leņķa slīpmašīnu. Katrā laukumā sagrieziet vienu no stūriem.
Otrā pusē un pretējā stūrī, no sazāģētā stūra, urbjiet atveri skrūvei, kas palīdzēs plātnes turēt kopā. Elektrolizators nebeidz darboties šādi:t plāksnes elektrība plūst uz plāksni - un ūdens sadalās skābeklī un ūdeņradī. Pateicoties tam, mums ir nepieciešama laba un negatīva plāksne.
Plātnēm jābūt savienotām pārmaiņus: plus-mīnus-plus-mīnus, izmantojot līdzīgu metodi, būs spēcīga strāva. Lai izolētu plāksnes viena no otras, tiek izmantota caurule. No līmeņa tiek sagriezts gredzens. Nogriežot to, mēs iegūstam milimetru biezu sloksni. Šis attālums ir pareizāks gāzes pagatavošanai.
Plātnes ir savstarpēji savienotas ar paplāksnēm: mēs uz skrūves uzliekam paplāksni, pēc tam plāksni un trīs paplāksnes, tad atkal plāksni utt. Uz plus un mīnus jāstāda astoņas plāksnes. Ja viss ir izdarīts pareizi, tad plākšņu griezumi neskar elektrodus.
Pēc tam jums būs jāpievelk uzgriežņi un jāizolē plāksnes. Tad mēs ievietojam struktūru plastmasas traukā.
Elektrolītisko elementu ražotāju pārskats
Galvenie elektrolizatoru ražotāji ir gan vietējie uzņēmumi (RUSAL, NPF RutTech, AS Uralkhimmash), gan arī to ārvalstu konkurenti - Teledyne Energy Systems, Inc (ASV), Hydrogenics Corp. (Beļģija).
Tādējādi elektrolizators ir diezgan vienkārša un ar funkcijām bagāta iekārta, ko izmanto skābekļa ūdeņraža gāzes ražošanai, kuru nākotnē plānots izmantot kā degvielu iekšdedzes motoriem un apkures katliem.
Pašmāju mājas elektrolīze
Kad es biju maza, es vienmēr gribēju kaut ko darīt pats, ar savām rokām. Bet vecāki (un citi tuvi cilvēki) vairumā gadījumu to neatļāva. Un es toreiz neredzēju (un līdz šim neredzu) neko sliktu, kad mazi bērni vēlas mācīties ??
Protams, es nerakstīju šo rakstu, lai atsauktu atmiņā bērnības vēlmi sākt pašizglītību. Tikai nejauši, sērfojot internetā, man nāca klajā ar šāda veida jautājumu. Kāds mazs bumbvedējs uzdeva jautājumus par elektrolīzes veikšanu mājās. Tiesa, es viņam neatbildēju, jo šis zēns gribēja sāpīgi aizdomīgo maisījumu elektrolizēt ?? Es nolēmu, ka grēka dēļ vairs neteikšu, ļaujiet man pašai meklēt grāmatās. Bet ne tik sen, atkal klīstot pa forumiem, es redzēju līdzīgu jautājumu no ķīmijas skolas pasniedzēja. Spriežot pēc apraksta, viņa skola ir tik nabadzīga, ka tā nevar (nevēlas) nopirkt elektrolizatoru par 300 rubļiem. Skolotājs (kāda problēma!) Nevarēja atrast izeju no radušās situācijas. Tāpēc es viņam palīdzēju. Tiem, kuriem ir interese par šāda veida pašmāju izstrādājumiem, es ievietoju šo rakstu vietnē.
Patiesībā ražošanas process un mūsu āmura izmantošana ir ļoti primitīva. Bet es vispirms pastāstīšu par drošību un par ražošanu - jau otrajā. Un lieta ir tāda, ka mēs runājam par demonstratīvu elektrolizatoru, nevis par rūpniecisku instalāciju. Pateicoties tam, drošības labad būs labi to darbināt nevis no tīkla, bet gan no AA baterijām vai no akumulatora. Protams, jo lielāks spriegums, jo ātrāk notiks elektrolīzes process. Tomēr, lai vizuāli novērotu gāzes burbuļus, tas ir diezgan pietiekami 6 V, bet 220 jau ir pārmērīgs. ar šādu spriegumu, piemēram, ūdens vārīsies ātrāk nekā jebkas cits, bet tas nav ļoti droši ... Nu, es domāju, ka jūs to esat izdomājis ar spriedzi?
Tagad parunāsim par to, kur un kādos apstākļos mēs eksperimentēsim. Vispirms tam vajadzētu būt vai nu brīvai vietai, vai labi vēdināmai telpai. Lai gan es visu izdarīju dzīvoklī ar slēgtiem logiem un neko tamlīdzīgu? Otrkārt, eksperimentu vislabāk var izdarīt uz laba galda. Vārds "labs" nozīmē, ka galdam jābūt stabilam un labākam smagam, stingram un piestiprinātam pie grīdas virsmas. Šajā gadījumā galda pārklājumam jābūt izturīgam pret agresīvām vielām. Starp citu, flīze no flīzes ir ideāli piemērota tam (lai gan ne katrs, diemžēl). Šāds galds noderēs ne tikai šai pieredzei. Tomēr es visu izdarīju uz parasta izkārnījuma ?? Treškārt, eksperimenta laikā jums nav jāpārvieto barošanas avots (manā gadījumā akumulatori). Pateicoties tam, lai nodrošinātu uzticamību, vislabāk ir nekavējoties tos nolikt uz galda un nofiksēt tā, lai tie nepakustētos. Ticiet man, tas ir ērtāk nekā regulāri turēt ar rokām. Es vienkārši piesēju savas baterijas ar elektrisko lenti pie pirmā cietā priekšmeta, kas nāca pāri. Ceturtkārt, ēdieni, kuros sāksim eksperimentēt, lai tie būtu mazi. Vienkāršs stikls vai šāvēja stikls. Starp citu, tas ir optimālākais veids, kā lietot brilles mājās, pretstatā alkohola lietošanai tajos ar turpmāku lietošanu ...
Nu, tagad pievērsīsimies tieši ierīcei. Tas ir paredzēts attēlā, bet pagaidām es īsi paskaidrošu, kas un kas.
Mums jāņem vienkāršs zīmulis un ar parasto nazi no tā jānoņem koks un no zīmuļa jāizņem vesels svins. Tomēr jūs varat ņemt vadību no mehāniskā zīmuļa. Bet vienlaikus ir divas grūtības. Pirmais ir parastais. Mehāniskā zīmuļa svins ir pārāk plāns, mums tas vienkārši nav piemērots vizuālam eksperimentam. Otra grūtība ir kaut kāds nesaprotams pašreizējo šīfera sastāvs. Ir sajūta, ka tie nav izgatavoti no grafīta, bet no kaut kā cita. Kopumā mana pieredze ar šādu "svinu" nemaz nebija veiksmīga pat pie 24 V sprieguma. Pateicoties tam, man bija jāizvēlas labs koksnes vienkāršs zīmulis. Iegūtais grafīta stienis mums kalpos kā elektrods. Kā jūs varat iedomāties, mums ir vajadzīgi divi elektrodi. Pateicoties tam, mēs ejam izvēlēties otro zīmuli vai vienkārši sadalīt esošo stieni divās daļās. Es to tiešām izdarīju.
Ar jebkuru vadu, kas nāk pie rokas, mēs iesaiņojam pirmo svina elektrodu (ar vienu stieples galu), un mēs savienojam šo vadu ar strāvas avota mīnusu (ar otru galu). Tad mēs uzņemamies otro vadību un darām to pašu ar to. Lai to izdarītu, pamatojoties uz to, mums ir nepieciešams otrais vads. Bet šajā gadījumā mēs savienojam šo vadu ar strāvas avota plusu. Ja jums ir problēmas ar trauslā grafīta stieņa piestiprināšanu pie stieples, varat izmantot pieejamos rīkus, piemēram, lenti vai līmlenti. Ja neizdevās grafīta galu ietīt ar pašu vadu, un lente vai izolācijas lente nenodrošināja ciešu kontaktu, tad mēģiniet pielīmēt svinu ar vadošu līmi. Ja jums tas nav, tad vismaz piesieniet vadu pie stieples ar vītni. Nav jābaidās, diegs neizdegs no šāda sprieguma ??
Tiem, kas neko nezina par akumulatoriem un vienkāršiem noteikumiem to pievienošanai, es nedaudz paskaidrošu. Pirkstu tipa akumulators rada 1,5 V spriegumu. Attēlā man ir divas līdzīgas baterijas. Turklāt tie ir savienoti pakāpeniski - viens pēc otra, nevis paralēli. Ar šādu (sērijas) savienojumu galīgais spriegums tiks summēts no katras akumulatora sprieguma, tas ir, man tas ir 1,5 + 1,5 = 3,0 V. Tas ir mazāks nekā iepriekš deklarētie 6 volti. Bet man bija slinkums iet pirkt vēl dažas baterijas. Princips jūs un tāpēc jābūt skaidram ??
Sāksim eksperimentu. Piemēram, aprobežosimies ar ūdens elektrolīzi.Pirmkārt, tas ir ļoti pieejams (es ceru, ka šī raksta lasītājs nedzīvo Sahārā), otrkārt, tas ir nekaitīgs. Turklāt es parādīšu, kā ar to pašu ierīci (elektrolizatoru) ar to pašu vielu (ūdeni) veikt divus dažādi pieredze. Es domāju, ka jums ir pietiekami daudz iztēles, lai izdomātu kaudzi līdzīgu eksperimentu ar citām vielām ?? Kopumā krāna ūdens mums ir piemērots. Bet es iesaku to pievienot nedaudz vairāk un sālīt. Nedaudz - tas nozīmē nelielu šķipsnu, nevis veselu deserta karoti. Tas ir svarīgi! Labi samaisiet sāli, lai izšķīdinātu. Tātad ūdens, būdams dielektrisks tīrā stāvoklī, lieliski vadīs elektrību. eksperimenta sākumā noslaukiet galdu no iespējamā mitruma un pēc tam uzlieciet strāvas avotu un glāzi ūdens.
Abus elektrodus, kas atrodas zem sprieguma, mēs nolaižam ūdenī. Tajā pašā laikā pārliecinieties, ka ūdenī ir iegremdēts tikai grafīts, un pats vads nedrīkst pieskarties ūdenim. Eksperimenta sākums var kavēties. Laiks ir atkarīgs no daudziem rādītājiem: no ūdens sastāva, vadu kvalitātes, grafīta kvalitātes un, protams, no strāvas avota sprieguma. Manas reakcijas sākums aizkavējās pāris sekundes. Skābeklis sāk attīstīties uz elektroda, kas bija savienots ar bateriju plusu. Ūdeņradis izdalīsies uz elektroda, kas savienots ar mīnusu. Jāatzīmē, ka ūdeņraža burbuļu ir vairāk. Ap grafīta daļu, kas ir iegremdēta ūdenī, pielīp ļoti mazi burbuļi. Tad daži burbuļi sāk peldēt.
Elektrods eksperimenta sākumā. Pagaidām nav gāzes burbuļu. Ūdeņraža burbuļi, kas izveidojušies uz elektroda, kas savienots ar bateriju negatīvo polu
Kādi vēl eksperimenti var būt? Ja jūs jau esat pietiekami daudz spēlējis ar ūdeņradi un skābekli, mēs turpinām citu eksperimentu. Tas ir interesantāk, it īpaši mājas pētniekiem. Tas ir interesanti ar to, ka to ir iespējams ne tikai redzēt, bet arī saost. Iepriekšējā pieredzē mēs saņēmām skābekli un ūdeņradi, kas, manuprāt, nav īpaši iespaidīgi. Un citā eksperimentā mēs iegūstam divas vielas (starp citu, noderīgas ikdienas dzīvē). eksperimenta sākumā pārtrauciet iepriekšējo eksperimentu un nosusiniet elektrodus. Tagad paņemiet galda sāli (kuru parasti lietojat virtuves telpā) un izšķīdiniet to ūdens masā. Šajā gadījumā ne mazums. Patiesībā pienācīgs sāls daudzums ir vienīgais, kas otro pieredzi padara atšķirīgu no pirmās. Pēc sāls izšķīdināšanas jūs varat nekavējoties atkārtot eksperimentu. Tagad notiek cita reakcija. Uz laba elektroda tagad izdalās nevis skābeklis, bet gan hlors. Un negatīvā gadījumā izdalās arī ūdeņradis. Kas attiecas uz stiklu, kurā atrodas sāls šķīdums, tajā pēc ilgstošas elektrolīzes paliek nātrija hidroksīds. Šī ir pazīstamā kaustiskā soda, sārmi.
Hlors, jūs to varēsiet saost. Bet, lai panāktu vislabāko efektu, es iesaku ņemt spriegumu vismaz 12 V. Pretējā gadījumā jūs, iespējams, nejūtat aromātu. Sārmu klātbūtni (pēc ļoti ilgas elektrolīzes) stiklā var pārbaudīt vairākos veidos. Visvienkāršākais un vardarbīgākais ir iebāzt roku glāzē. Etniskā zīme saka, ka, ja sākas dedzinoša sajūta, glāzē ir sārmi. Gudrāks un atšķirīgāks veids ir lakmusa papīrs. Ja jūsu skola ir tik nabadzīga, ka tā pat nespēj iegūt lakmusu, jums palīdzēs ērti rādītāji. Viens no šiem, kā saka, var kalpot kā biešu sulas piliens ?? Bet ir pilnīgi iespējams šķīdumā vienkārši pilināt nedaudz tauku. Cik es zinu, vajadzētu veikt pārziepošanu.
Ļoti ziņkārīgajiem es aprakstīšu, kas patiesībā notika eksperimentu laikā. Pirmajā eksperimentā elektriskās strāvas ietekmē notika līdzīga reakcija: 2 H2O >>> 2 H2 + O2 Abas gāzes dabiski peld no ūdens uz virsmu. Starp citu, peldošās gāzes var notvert. Vai jūs varat to izdarīt pats?
Citā eksperimentā reakcija bija pilnīgi atšķirīga.To izraisīja arī elektriskā strāva, bet tagad kā reaģenti darbojās ne tikai ūdens, bet arī sāls: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Paturiet prātā, ka reakcijai jānotiek ūdens pārpalikumā. Lai uzzinātu, kāds sāls daudzums tiek uzskatīts par vislielāko, varat to saskaitīt no iepriekš minētās reakcijas. Varat arī domāt par to, kā uzlabot ierīci vai kādus citus eksperimentus var veikt. Patiešām, iespējams, ka nātrija hipohlorītu var iegūt elektrolīzes ceļā. Laboratorijas apstākļos vairumā gadījumu to iegūst, gāzveida hloru izlaižot caur nātrija hidroksīda šķīdumu.