Hem endüstride hem de günlük yaşamda geniş uygulama alanı bulan birçok fizikokimyasal işlemden biri elektrolizdir - bir çözelti veya eriyik içine yerleştirilmiş bir akım kaynağına bağlı elektrotların yüzeylerindeki seçim, bileşenleri (saf metal - alüminyum, bakır, gaz vb.). Bu işlemin gerçekleştiği ana kurulum bir elektrolizördür.

Elektrolizör
Elektrolizör nedir
Bir elektrolizör, bileşenlerini bir çözelti veya eriyikten ayırmak için kullanılan özel bir kurulumdur.
Elektrolizörün temel özellikleri şunlardır:
- Bir elektrot için çalışma voltajı 1,8 ila 2,0 V arasında değişir;
- Akım gücü - elektroliz işleminin normal seyri için, elektrotlara bu özelliğin değeri 5 ila 10 A arasında bir akım verilir;
- Elektrot sayısı - minimum elektrot sayısı 2'dir, maksimum, kurulumun boyutu ve amacı ile sınırlıdır;
- Elektrotların boyutları - elektrot olarak karbon çubuklar değil, boyutları kurulum amacına göre belirlenen metal plakalar, plakalara verilen akımın akım-voltaj karakteristiği;
- Zıt yüklü elektrot yüzeyleri arasındaki mesafe - elektrot plakaları arasındaki minimum mesafe en az 1,5 mm olmalıdır;
- Elektrot malzemesi - modern elektrolizörlerde, anot ve katot malzemesi olarak nikel içeren paslanmaz çelik sac kullanılır.
Bir elektroliz tesisinin bir diğer önemli özelliği de katalizörlerin kullanılmasıdır.
Bu tür kurulumlar aşağıdaki amaçlar için kullanılır:
- Hidrojen ve oksijen karışımından (Brown gazı) oluşan bir oksihidrojen gazının elde edilmesi;
- Saf alüminyum, magnezyum, çinkonun eriyik tuzlarından izolasyonu;
- Suyun içinde çözünen tuzlardan ve safsızlıklardan arındırılması;
- Metal parçaların yüzeyinde korozyonu önleyen ince bir nikel, çinko tabakası uygulaması;
- Gıda ürünlerinin dezenfeksiyonu;
- Atık suyun çözünmüş ağır metal tuzlarından ve diğer zararlı maddelerden arıtılması.
Önemli! Sıradan demirden yapılan platin elektrot, elektroliz tesislerinde paslanmaz çelikten daha az kullanılır, çünkü daha hızlı oksitlenir ve kullanılamaz hale gelir.
Kendi kendine yapılan elektrolizör
Herkes kendi elleriyle elektrolizör yapabilir. En yaygın tasarımın montaj süreci için aşağıdaki malzemelere ihtiyaç duyulacaktır:
- paslanmaz çelik sac (en iyi seçenekler yabancı AISI 316L veya bizim 03X16H15M3'dür);
- cıvatalar М6х150;
- pullar ve somunlar;
- şeffaf tüp - inşaat amaçlı kullanılan bir su terazisi kullanabilirsiniz;
- dış çapı 8 mm olan birkaç balıksırtı bağlantı parçası;
- 1,5 litre hacimli plastik kap;
- musluk suyunu filtreleyen küçük bir filtre, örneğin çamaşır makineleri için bir filtre;
- geri dönüşsüz su vanası.
Montaj süreci
Elektrolizörü aşağıdaki talimatlara göre kendi ellerinizle toplayın:
- Her şeyden önce, paslanmaz çelik sacın işaretlenmesi ve ardından aynı kareler halinde kesilmesi gerekir. Kesme, açılı taşlama makinesi (açılı taşlama) ile yapılabilir. Bu tür karelerdeki köşelerden biri, plakaları doğru şekilde sabitlemek için belirli bir açıyla kesilmelidir;
- Daha sonra, köşe testere kesiminin karşısındaki plakanın tarafındaki cıvata için bir delik açmanız gerekir;
- Plakaların bağlantısı sırayla yapılmalıdır: bir plaka "+", diğeri "-" vb.
- Farklı yüklü plakalar arasında, su terazisinden bir tüp görevi gören bir yalıtkan bulunmalıdır.1 mm kalınlığında şeritler elde etmek için uzunlamasına kesilmesi gereken halkalar halinde kesilmelidir. Plakalar arasındaki bu mesafe, elektroliz sırasında iyi bir gaz çıkışı için yeterlidir;
- Plakalar, aşağıdaki gibi rondelalar kullanılarak birbirine sabitlenir: cıvata üzerine bir rondela, ardından bir plaka, ardından üç rondela, bir plakadan sonra vb. Uygun şekilde yüklenmiş plakalar, negatif yüklü tabakaların ayna görüntüsüne yerleştirilir. Bu, kesilmiş kenarların elektrotlara temas etmesini önlemeyi mümkün kılar;


Elektroliz tesisinin plakaları bir araya getirildi
- Plakaları monte ederken, aynı anda onları izole etmeli ve somunları sıkmalısınız;
- Ayrıca, kısa devre olmadığından emin olmak için her bir plakanın halkalanması gerekir;
- Ayrıca, tüm tertibat plastik bir kutuya yerleştirilmelidir;
- Bundan sonra, cıvataların kabın duvarlarına temas ettiği, iki delik açtığınız yerleri vurgulamakta fayda var. Cıvatalar kaba sığmazsa, demir testeresi ile kesilmeleri gerekir;
- Daha sonra yapının sıkılığı için cıvatalar somun ve rondelalarla sıkılır;


Plastik bir kaba yerleştirilmiş plakalar
- Atılan adımlardan sonra, kap kapağında delikler açmanız ve bağlantı parçaları bunlara yerleştirmeniz gerekecektir. Bu durumda sızdırmazlık, derzlerin silikon bazlı sızdırmazlık maddeleri ile kapatılmasıyla sağlanabilir;
- Yapıdaki bir emniyet valfi ve filtre, gazın çıkışına yerleştirilmiştir ve aşırı gaz birikimini kontrol etmek için bir araç olarak hizmet eder, bu da kötü sonuçlara yol açabilir;
- Elektroliz ünitesi monte edildi.
Son aşama, benzer şekilde gerçekleştirilen bir testtir:
- kabın bağlantı elemanları için cıvataların işaretine kadar suyla doldurulması;
- cihaza güç bağlamak;
- karşı ucu suya indirilmiş olan borunun bağlantı parçasına bağlantı.
Tesisata zayıf bir akım verilirse, gazın tüpten salınması neredeyse farkedilemez, ancak onu elektrolizörün içinden izlemek mümkün olacaktır. Alternatif akımı artırarak, suya bir alkali katalizör ekleyerek, gaz halindeki maddenin verimi önemli ölçüde artırılabilir.
Yapılan elektrolizör, kural olarak, birçok cihazın, örneğin bir hidrojen brülörünün önemli bir parçasıdır.


temeli kendi kendine yapılan bir elektrolizör olarak kabul edilen bir hidrojen brülörünün görünümü
İyonik tesisatların tiplerini, temel özelliklerini, cihazını ve çalışma prensibini bilerek, çeşitli günlük durumlarda mükemmel bir yardımcı olan kendi kendine yapılan bir yapının doğru montajını gerçekleştirebilirsiniz: kaynak yapmaktan ve motorlu araçların yakıt tüketiminden tasarruf etmeye kadar. ısıtma sistemlerinin işleyişi.
Cihaz ve çalışma prensibi
Katot ve anot
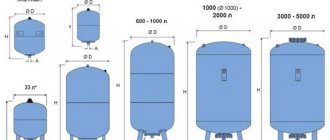
En basit elektroliz tesisi, her biri aşağıdakileri içeren birkaç "hücreden" oluşur:
- 2 plaka elektrodu - katot (negatif) ve anot (pozitif);
- İki bitişik farklı elektrotun çevresinde lastik bir conta.
Dış hücreler, içinden gelişen gazların boşaltıldığı özel borularla donatılmıştır.
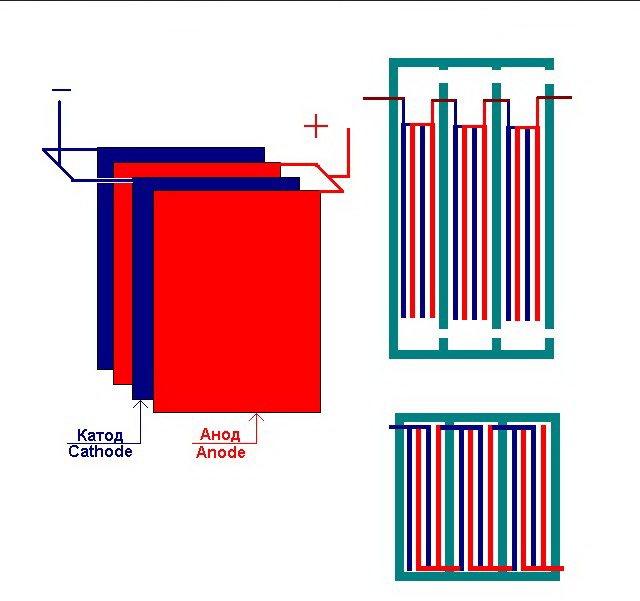

Elektroliz tesisinin birbirine bağlı birkaç "hücresi"
Elektrolizör 1 ila 30-40 veya daha fazla bu tür "hücre" içerebilir, aynı adı taşıyan plakalar seri olarak bağlanır.
Önemli! Alternatif akımlı güç kaynaklarını kullanırken, en basit olanı bir diyot köprüsü olan redresörler ek olarak kullanılır.
Böyle bir kurulum aşağıdaki gibi çalışır:
- İçinde çözünmüş alkali veya sıradan kabartma tozu içeren damıtılmış su, elektrotlar arasındaki boşluğa dökülür;
- Güç kaynağından kurulumun tüm hücrelerinin elektrotlarına 1.8-2.0 V voltaj verilir;
- Elektroliz işleminin bir sonucu olarak, suda çözünen bir maddenin anyonları (pozitif yüklü iyonlar) negatif yüklü katoda çekilir ve bunun sonucunda üzerinde ince bir sodyum filmi oluşur;
- Pozitif yüklü bir anot üzerinde, her biri 2 hidrojen atomu ve 1 oksijen atomu oluşturarak su moleküllerinin yok edilmesi meydana gelir;
- Branşman borularından salınan patlayıcı gaz, kendisi için tasarlanan konteynere girer.
Elektroliz işleminin yoğunluğu, gerilime ve akım gücüne bağlıdır - bu özelliklerin düşük değerlerinde işlem devam etmeyecektir. Güç kaynağı, akım-voltaj karakteristiğinin çok yüksek değerlerine sahip bir akım sağlarsa, elektrolizöre dökülen çözelti çok sıcak olacak ve kaynayacaktır.
Cihazın hata ayıklaması ve test edilmesi
Daha sonra cıvataların kutunun duvarlarına nerede dokunduğunu belirlemek ve bu yerlerde iki delik açmak gerekir. Belirgin bir sebep olmadan cıvataların kaba sığmadığı ortaya çıkarsa, o zaman yapmaları gerekir. somunlarla sıkılık için kesin ve sıkın... Şimdi kapağı delmeniz ve dişli konektörleri her iki taraftan oraya yerleştirmeniz gerekiyor. Sızdırmazlığı sağlamak için, derz silikon esaslı bir dolgu macunu ile kapatılmalıdır.
Kendi elektrolizörünüzü kendi ellerinizle monte ettikten sonra test etmelisiniz. Bunu yapmak için cihazı bir güç kaynağına bağlayın, cıvatalara su ile doldurun, armatüre bir tüp bağlayarak ve tüpün karşı ucunu suya indirerek kapağı kapatın. Akım zayıfsa, akım elektrolizörün içinden görünecektir.
Ev yapımı cihazınızdaki akımı kademeli olarak artırın. Damıtılmış su, tuz veya safsızlık içermediğinden elektriği iyi iletmez. Elektroliti hazırlamak için suya alkali eklemek gerekir. Bunu yapmak için, sodyum hidroksit almanız gerekir ("Mole" tipi boru temizleyicilerinde bulunur). Yeterli miktarda gazın birikmesini önlemek için bir emniyet valfine ihtiyaç vardır.
- Katalizör olarak damıtılmış su ve soda kullanmak daha iyidir.
- Biraz karbonat kırk ölçü su ile karıştırmalısınız. Yanlardaki duvarlar en iyi akrilik camdan yapılmıştır.
- Elektrotlar en iyi şekilde paslanmaz çelikten yapılır. Tabaklar için altın kullanmak mantıklı.
- Destek için yarı saydam PVC kullanın. 200 x 160 milimetre boyutlarında olabilirler.
- Benzinin arabalarda ve çoğu durumda tamamen yanması için yemek pişirmek için kendi yaptığınız kendi elektrolizörünüzü kullanabilirsiniz.
Kuru elektrolizörler genellikle makinelerde kullanılır. Jeneratör yanmalı motorun gücünü arttırır. Hidrojen, sıvı yakıttan çok daha hızlı tutuşarak pistonun gücünü artırır. Mole'a ek olarak, Mister Muscle, kostik soda, kabartma tozu alabilirsiniz.
Jeneratör içme suyu üzerinde çalışmaz. Elektriği şu şekilde bağlamak daha iyidir: ilk ve son plaka - eksi ve ortadaki plaka üzerinde - artı. Plakaların alanı ne kadar büyükse ve akım ne kadar güçlü olursa, o kadar fazla gaz salınır.
Elektrolizör türleri
Piller için DIY punta kaynağı
Tasarım ve çalışma prensibine bağlı olarak 5 tip elektroliz tesisi vardır.
Kuru
Bu elektrolizörler, sızdırmaz kauçuk contalarla ayrılmış plaka elektrotlarından oluşur. Çoğu zaman tesisatın "hücreleri" ek olarak kapalı bir muhafaza içine yerleştirilir.
Elektroliz sonucu oluşan hidrojen ve oksijen, gövde ucunda bulunan özel branşman boruları veya tesisatın en uç plakaları vasıtasıyla uzaklaştırılır.
Akan
Bu türdeki elektroliz tesisatları aşağıdaki cihaza sahiptir:
- Biri içinden elektrolit beslenen iki nozullu bir elektroliz banyosu (gövde), ikincisi içinden elektroliz sonucu oluşan patlayıcı gaz boşaltılır;
- Ara parçalarla ayrılmış plaka elektrotları;
- Gövdenin üzerine elektrotlarla yerleştirilmiş ve hortumlarla tesisatın elektroliz banyosunun branşman borularına bağlanmış ve üst kısmında gaz vanası olan bir branşman borusu bulunan elektrolitli bir tank.
Böyle bir cihazın çalışması sırasında, branşman borusundan ve hortumdan gelişen gaz, elektrolit ile tanka girer ve içinde belirli bir basınç oluşturarak, branşman borusundaki vanadan tesisatı terk eder.
Zar
Bu tür tesisatların elektroliz hücreleri, elektroliz ürünlerinin geçmesine izin veren ve elektrotları birbirinden ayıran ince bir zarla ayrılmış iki elektrottan oluşur.
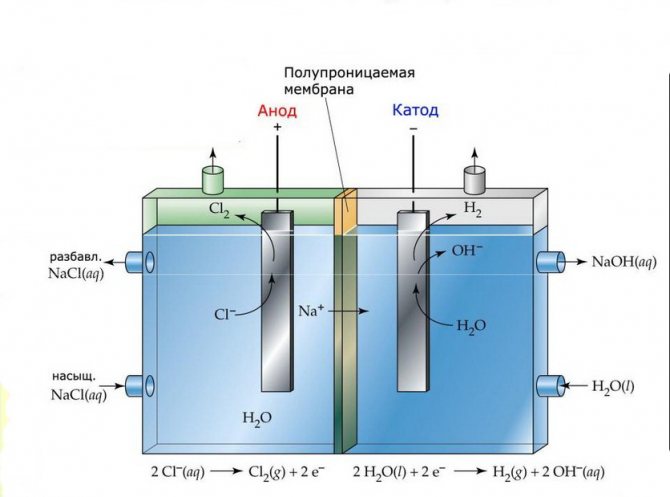

Membran elektroliz tesisi
Diyafram
Bu tipteki elektroliz tesisleri, içine iki elektrot yerleştirilmiş "U" şeklinde bir şişeden ve 2-3 geçirimsiz diyaframdan oluşur. Saf hidrojen ve oksijenin ayrı üretimi için benzer elektrolizörler kullanılır.
Alkali
Diğer elektrolizör modellerinden farklı olarak, bunlarda, sadece ek bir hidrojen ve oksijen kaynağı değil, aynı zamanda elektroliz için bir katalizör olan bir elektrolit - kostik soda (sodyum hidroksit) olarak bir alkali çözelti kullanılır.
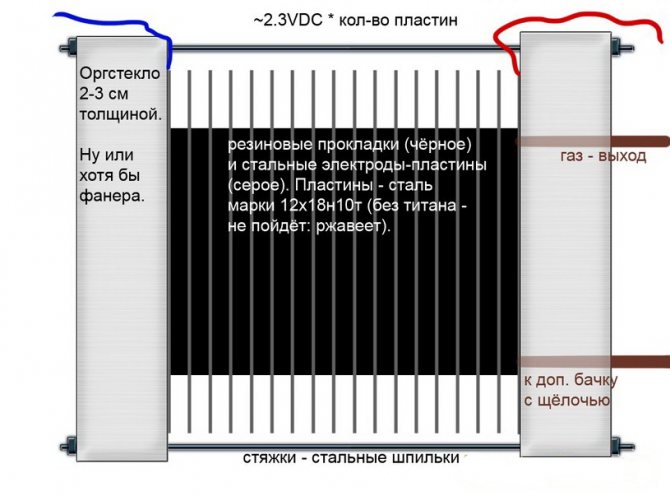

Alkali elektrolizör devresi
Bu tür kurulumlar, diğer tiplerdeki analogların aksine, sıradan demirden yapılmış daha ucuz elektrotların kullanılmasına izin verir.
Elektrolizörü kendi ellerinizle yapın
Elbette, ilkokul müfredatından elektroliz sürecine aşinasınız. Bu, saf hallerinde metaller veya metal olmayanlar elde etmek için 2 kutuplu elektrotun akım altında suya yerleştirildiği zamandır. Su moleküllerini oksijen ve hidrojene ayrıştırmak için bir elektrolizöre ihtiyaç vardır. Elektrolizör, bilimsel mekanizmaların bir parçası olarak molekülleri iyonlara ayırır.
Bu cihazın iki türü vardır:
- Kuru elektrolizör (bu tamamen kapalı bir hücredir);
- Islak elektrolizör (bunlar bir su kabına yerleştirilmiş iki metal plakadır).
Bu cihaz, cihaz açısından basittir, bu da bunu mümkün kılar evde bile kullan... Elektrolizörler, moleküllerin atomlarının elektroliz yüklerini yüklü atomlara böler.
Bizim durumumuzda suyu pozitif hidrojen ve negatif oksijene böler. Bunu yapmak için büyük miktarda enerji gerekir ve gerekli enerjiden daha azını yapmak için bir katalizör kullanılır.
Hidrojen üretimi için elektrolizör
Topraklama hesabı
En basit elektrolizörü kendi ellerinizle monte etmek için şekilde gösterilen çizimi kullanabilirsiniz.
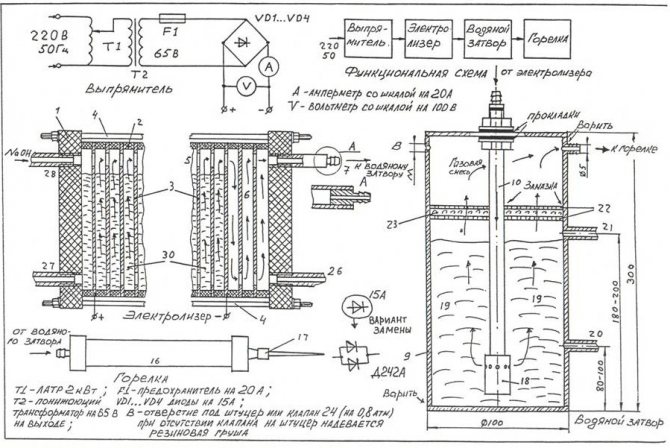

En basit ev yapımı elektrolizörün çizimi
Not! Bir elektrolizör, çalışma sırasında büyük miktarlarda biriken oksihidrojen gazı ciddi bir patlamaya neden olabilecek oldukça tehlikeli bir kurulumdur. Ünite açık ateş kaynaklarının, ısıtma cihazlarının yakınına yerleştirilmemelidir.
Bir araba için elektrolizör
Bir araba motorunda yakıtın yanmasını iyileştirmek için, içine yerleştirilmiş paslanmaz çelik plakalara sahip eski bir bataryadan bir kasa, biri elektrolit ile doldurulmuş bir tanka bağlı iki nozuldan oluşan bir elektrolizör monte edilir, ikincisi motora bir hava besleme hortumuna bağlanır (daha doğrusu, hava girişinden hava filtresine bir oluklu ile).
Böyle bir ev yapımı akan elektrolizör, bir röle ve 10 A sigorta kullanılarak aracın aküsünden beslenir.
Kendi ellerimizle bir cihaz yaratıyoruz
Bu işlem için cihaz elle yapılabilir.
Bunun için ihtiyacınız olacak:
- Paslanmaz çelik sac;
- Cıvatalar M6 x 150;
- Yıkayıcılar;
- Fındık;
- Şeffaf tüp;
- Her iki tarafta da dişli bağlantı elemanları;
- Bir buçuk litrelik plastik kap;
- Su filtresi;
- Su için çek valf.
Paslanmaz çelik için mükemmel bir seçenek, yabancı bir üreticinin AISI 316L veya ülkemizden bir üreticinin 03X16H15M3'dür. Kesinlikle paslanmaz çelik satın almaya gerek yoktur, eskisini alabilirsiniz. 50 ila 50 santimetre sizin için yeterli.
"Neden paslanmaz çeliği kendisi alalım?" - sen sor. En yaygın metal paslanacağından. Paslanmaz çelik, alkalileri daha iyi tolere eder. Meli Sayfayı 16 benzer kareye bölecek şekilde ana hatlarıyla belirtin... Açılı taşlama makinesi ile kesebilirsiniz. Her karede köşelerden birini kesin.
Diğer tarafta ve karşı köşede, kesilmiş köşeden, plakaları bir arada tutmaya yardımcı olacak bir cıvata için bir delik açın. Elektrolizör şu şekilde çalışmayı durdurmaz:t plaka elektriği plakaya akar - ve su, oksijen ve hidrojene ayrışır. Bu sayede iyi ve negatif bir plakaya ihtiyacımız var.
Plakalar dönüşümlü olarak bağlanmalıdır: artı-eksi-artı-eksibenzer bir yöntemle güçlü bir akım oluşacaktır. Plakaları birebir yalıtmak için bir tüp kullanılır. Seviyeden bir yüzük kesilir. Keserek milimetre kalınlığında bir şerit elde ederiz. Bu mesafe gaz yapmak için daha doğrudur.
Plakalar rondelalarla birbirine bağlanır: cıvataya bir rondela, ardından bir plaka ve üç rondela, sonra tekrar bir plaka vb. Artı ve eksi üzerine sekiz tabak ekilmelidir. Her şey doğru yapılırsa, plakaların kesikleri elektrotlara temas etmeyecektir.
O zaman somunları sıkmanız ve plakaları izole etmeniz gerekir. Ardından yapıyı plastik bir kaba yerleştiriyoruz.
Elektrolizör üreticilerine genel bakış
Elektrolizörlerin ana üreticileri hem yerli işletmelerdir (RUSAL, NPF RutTech, JSC Uralkhimmash) hem de yabancı rakipleri - Teledyne Energy Systems, Inc (ABD), Hydrogenics Corp. (Belçika).
Bu nedenle, elektrolizör, ileride içten yanmalı motorlar ve kalorifer kazanları için yakıt olarak kullanılması planlanan oksihidrojen gazı üretmek için kullanılan oldukça basit ve zengin özelliklere sahip bir kurulumdur.
Kendin yap evde elektrolizi
Küçükken her zaman kendi ellerimle bir şeyler yapmak isterdim. Ancak çoğu durumda ebeveynler (ve diğer yakın insanlar) buna izin vermedi. Küçük çocuklar öğrenmek istediğinde o zaman (ve şimdiye kadar görmüyorum) kötü bir şey görmedim ??
Elbette bu makaleyi kendi kendine eğitime başlama arzusundaki çocukluk deneyimlerini hatırlamak için yazmadım. Sadece tesadüfen, internette gezinirken bu tür bir soruyla karşılaştım. Küçük bir bombacı çocuk evde elektrolizin nasıl yapılacağına dair sorular sordu. Doğru, ona cevap vermedim, çünkü bu çocuk acı verici şüpheli karışımı elektrolize etmek istedi ?? Günahtan daha fazlasını söylemeyeceğime karar verdim, kitaplara kendim bakayım. Ancak çok uzun zaman önce, forumlarda tekrar dolaşırken, bir kimya okulundaki bir öğretmenden benzer bir soru gördüm. Açıklamasına bakılırsa, okulu o kadar zayıf ki 300 ruble için bir elektrolizör satın alamıyor (istemiyor) Öğretmen (ne sorun!) Ortaya çıkan durumdan bir çıkış yolu bulamadı. Ben de ona yardım ettim. Bu tür ev yapımı ürünleri merak edenler için bu yazıyı sitede yayınlıyorum.
Aslında, üretim süreci ve kendi paletimizin kullanımı çok ilkel. Ama size önce güvenlikten, ikincisinde ise üretimden bahsedeceğim. Ve asıl mesele şu ki, bir endüstriyel tesis hakkında değil, bir gösteri elektrolizöründen bahsediyoruz. Bu sayede, güvenlik için ağdan değil, güç sağlamak iyi olacaktır. AA pillerden veya bir pilden. Doğal olarak, voltaj ne kadar yüksekse, elektroliz süreci o kadar hızlı ilerleyecektir. Bununla birlikte, gaz kabarcıklarının görsel olarak gözlemlenmesi için oldukça yeterli 6 Vama 220 zaten aşırı. Böyle bir voltajla, örneğin su en hızlı kaynar ve bu çok güvenli değil ... Sanırım gerilimi anladınız mı?
Şimdi nerede ve hangi koşullarda deneyeceğimizi konuşalım. İlk şey, ya boş alan ya da iyi havalandırılan bir oda olmalıdır. Her şeyi kapalı pencereli bir apartman dairesinde yapmama rağmen? İkincisi, deney en iyi şekilde iyi bir masada yapılır. "İyi" kelimesi, masanın sabit ve daha ağır, sert ve zemin yüzeyine tutturulmuş olması gerektiği anlamına gelir. Bu durumda masa örtüsü agresif maddelere dayanıklı olmalıdır. Bu arada, bir karodan kiremit bunun için mükemmeldir (maalesef her olmasa da). Bunun gibi bir masa sadece bu deneyim için kullanışlı olmayacak. Ancak, her şeyi sıradan bir tabure üzerinde yaptım ?? Üçüncüsü, deney sırasında güç kaynağını (benim durumumda piller) hareket ettirmenize gerek yoktur. Bu nedenle, güvenilirlik için, onları hemen masaya yatırmak ve bükülmemeleri için düzeltmek en iyisidir. İnan bana, bu onları düzenli olarak ellerinle tutmaktan daha uygun. Gördüğüm ilk sert nesneye kendi pillerimi bantla bağladım. Dördüncüsü, deneyeceğimiz yemekler küçük olsun. Basit bir bardak veya bir shot bardağı. Bu arada, gözlükleri daha fazla kullanımda içlerine alkol dökmek yerine evde kullanmanın en uygun yolu budur ...
Şimdi özellikle cihaza geçelim. Şekilde verilmiştir, ancak şimdilik kısaca neyi neyi açıklayacağım.
Basit bir kalem alıp ağacı sıradan bir bıçakla çıkarmamız ve kurşun kalemden bütün bir ipucu almamız gerekiyor. Bununla birlikte, mekanik bir kurşun kalemden bir ipucu alabilirsiniz. Ama aynı anda iki zorluk var. İlki olağan olanıdır. Mekanik bir kalemin ucu çok ince, bizim için bu görsel bir deney için uygun değil. İkinci zorluk, mevcut listelerin bazı anlaşılmaz kompozisyonlarıdır. Grafitten değil, başka bir şeyden yapılmış gibi geliyor. Genel olarak, böyle bir "kurşun" ile olan deneyimim, 24 V'luk bir voltajda bile hiç başarılı olmadı. Bu sayede, iyi bir odunsu basit kurşun kalem seçmem gerekiyordu. Ortaya çıkan grafit çubuk bizim için bir elektrot görevi görecek. Tahmin edebileceğiniz gibi iki elektrota ihtiyacımız var. Bu sayede ikinci kalemi seçmeye veya mevcut çubuğu ikiye ayırmaya gidiyoruz. Aslında bunu yaptım.
Elimize gelen herhangi bir telle, ilk kurşun elektrodu (telin bir ucu ile) sararız ve bu teli güç kaynağının eksi kısmına (diğer ucuyla) bağlarız. Sonra ikinci ipucunu alırız ve onunla aynısını yaparız. Bunun için buna dayanarak ikinci bir kabloya ihtiyacımız var. Ancak bu durumda, bu kabloyu güç kaynağının artı noktasına bağlarız. Kırılgan grafit çubuğu tele takmakta sorun yaşıyorsanız, bant veya koli bandı gibi eldeki aletleri kullanabilirsiniz. Grafitin ucunu telin kendisiyle sarmak işe yaramadıysa ve bant veya yalıtım bandı sıkı bir temas sağlamadıysa, o zaman ucu iletken tutkalla yapıştırmayı deneyin. Buna sahip değilseniz, en azından ucu bir iplikle tele bağlayın. Korkmanıza gerek yok, iplik bu kadar gerginlikten yanmayacak mı ??
Piller ve bunları bağlamanın basit kuralları hakkında hiçbir şey bilmeyenler için biraz açıklayacağım. Parmak tipi pil 1,5 V voltaj üretir. Resimde benzer iki pilim var. Üstelik birbirine bağlılar yavaş yavaş - birbiri ardına, paralel değil. Benzer (seri) bir bağlantıyla, son voltaj her bir pilin voltajından toplanacak, yani benim için 1.5 + 1.5 = 3.0 V. Bu, daha önce belirtilen 6 volttan daha az. Ama birkaç pil daha alamayacak kadar tembeldim. İlke siz ve bu yüzden açık olmalısınız ??
Deneye başlayalım. Örneğin, kendimizi suyun elektroliziyle sınırlayacağız.Birincisi, çok erişilebilir (umarım bu makalenin okuyucusu Sahra'da yaşamaz) ve ikincisi, zararsızdır. Ayrıca, aynı cihazla (elektrolizör) aynı maddeyle (su) iki kez nasıl yapıldığını göstereceğim. çeşitli deneyim. Diğer maddelerle bir dizi benzer deney yapmak için yeterli hayal gücünüz olduğunu düşünüyorum. Genelde musluk suyu bizim için uygundur. Ama biraz daha eklemenizi ve tuzlamanızı tavsiye ederim. Bir nebze - bu küçük bir tutam anlamına gelir, bütün bir tatlı kaşığı değil. Bu önemli! Çözünmesi için tuzu iyice karıştırın. Dolayısıyla saf halde bir dielektrik olan su, elektriği mükemmel şekilde iletecektir. deneyin başında, masayı olası nemden silin ve ardından güç kaynağını ve üzerine bir bardak su koyun.
Gerilim altında bulunan her iki elektrodu da suya indiriyoruz. Aynı zamanda, sadece grafitin suya daldırıldığından ve telin suya temas etmemesi gerektiğinden emin olun. Deneyin başlangıcı gecikebilir. Zaman birçok göstergeye bağlıdır: suyun bileşimine, tellerin kalitesine, grafitin kalitesine ve tabii ki güç kaynağının voltajına. Tepkimin başlangıcı birkaç saniye gecikti. Pillerin artı kısmına bağlanan elektrotta oksijen gelişmeye başlar. Eksi bağlı elektrotta hidrojen açığa çıkacaktır. Daha fazla hidrojen kabarcığı olduğu unutulmamalıdır. Grafitin suya batmış kısmının etrafına çok küçük kabarcıklar yapışır. Sonra baloncukların bir kısmı yüzmeye başlar.
Deneyin başında elektrot. Henüz gaz kabarcığı yok. Pillerin eksi kutbuna bağlanan elektrotta oluşan hidrojen kabarcıkları
Başka hangi deneyler olabilir? Hidrojen ve oksijenle yeterince oynadıysanız, başka bir deneye geçiyoruz. Özellikle ev araştırmacıları için daha ilginç. Sadece görmenin değil, koklamanın da mümkün olması ilginçtir. Geçmiş deneyimde, bence çok da muhteşem olmayan oksijen ve hidrojen aldık. Ve başka bir deneyde, iki madde elde ediyoruz (bu arada, günlük yaşamda yararlıdır). deneyin başında önceki deneyi durdurun ve elektrotları kurutun. Şimdi (genellikle mutfak odasında kullandığınız) sofra tuzu alın ve su kütlesinde eritin. Bu durumda, küçük bir miktar değil. Aslında, ikinci deneyimi ilkinden farklı kılan tek şey yeterli miktarda tuzdur. Tuzu çözdükten sonra deneyi hemen tekrarlayabilirsiniz. Şimdi farklı bir tepki oluyor. İyi bir elektrotta, şimdi salınan oksijen değil klordur. Negatif olarak, hidrojen de açığa çıkar. Tuz çözeltisinin bulunduğu cama gelince, uzun süreli elektrolizden sonra sodyum hidroksit içinde kalır. Bu tanıdık kostik soda, alkali.
Klor, kokusunu alabileceksiniz. Ancak en iyi etki için en az 12 V'luk bir voltaj almanızı tavsiye ederim. Aksi takdirde aromayı hissetmeyebilirsiniz. Camda alkali varlığı (çok uzun bir elektrolizden sonra) birkaç yolla kontrol edilebilir. En basit ve en şiddetlisi, elinizi bardağa koymaktır. Etnik bir alamet, yanma hissi başlarsa, camda alkali olduğunu söylüyor. Daha akıllı ve daha belirgin bir yol turnusol testidir. Okulunuz bir turnusol bile kazanamayacak kadar fakirse, kullanışlı göstergeler size yardımcı olacaktır. Bunlardan biri, dedikleri gibi, bir damla pancar suyu görevi görebilir mi? Ancak çözeltiye biraz yağ damlatmak oldukça mümkündür. Bildiğim kadarıyla sabunlaşma gerçekleşmeli.
Merak edenler için, deneyler sırasında gerçekte ne olduğunu anlatacağım. İlk deneyde, bir elektrik akımının etkisi altında, benzer bir reaksiyon gerçekleşti: 2 H2O >>> 2 H2 + O2 Her iki gaz da doğal olarak sudan yüzeye çıkar. Bu arada, yüzen gazlar sıkışabilir. Kendin yapabilecek misin?
Başka bir deneyde, reaksiyon tamamen farklıydı.Aynı zamanda bir elektrik akımı ile başlatıldı, ancak şimdi sadece su değil, aynı zamanda tuz da reaktif olarak işlev gördü: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Reaksiyonun fazla su içinde gerçekleşmesi gerektiğini unutmayın. En büyük miktarın ne kadar tuz olduğunu bulmak için, onu yukarıdaki reaksiyondan sayabilirsiniz. Yine de cihazı nasıl iyileştireceğinizi veya başka hangi deneylerin yapılabileceğini düşünebilirsiniz. Gerçekte, sodyum hipokloritin elektrolizle elde edilebilmesi mümkündür. Laboratuvar koşullarında, çoğu durumda, gaz halindeki klorun bir sodyum hidroksit çözeltisinden geçirilmesiyle elde edilir.